
按照WHO专家的话说,的风险就是患者有病却没有治疗药品。但是,如果有研发人员开发了药品,但是要限于目前保守的法规质控要求,不能及时让患者获得救命药品,也是非常遗憾的。长期以来,各国药典收载了很多评估药品成品和原辅料的微生物检测方法;这些方法为客观评价药品品质,并协助制药人员和监管人员以判断药品质量发挥了很大的作用。但是目前从最新观点看,大部分药典收载的微生物检测反复都是保守和滞后的,因为这些检测方法需要很长时间才可以给出最后检测结果。拿无菌检测为例,目前世界各国药典都规定无菌药品要培养14天,而这个培养时间对于很多癌症晚期患者而言,是非常难以忍受的煎熬。另外,有些药品有效期很短,例如电子辐射类药物;如果对于这些药品都采用常规微生物检测方法来判断和实施放行,患者和制药行业都要承受痛苦。
为了解决这些矛盾,各国技术专家不断开发和推出快速微生物检测技术(RMM)。目前,USP推出一个新的技术附录,详细阐释了对于效期较短的无菌药品,如何做才是更合理的。这份文件的名称是USP-1071《RAPID MICROBIAL TESTS FOR RELEASE OF STERILE SHORTLIFE PRODUCTS: A RISK-BASED APPROACH》,翻译中文为《有效期较短的无菌产品放行的快速微生物测试-基于风险的方法》。
笔者根据自己的理解,对全文进行了翻译和解析,希望可以为制药行业以及亟待救命药的患者提供帮助。
1 介绍
人们普遍认为,目前生长型的无菌检查法(培养期至少为14天)(见无菌检查〈71〉)不适用于效期较短的产品或准备立即使用的产品,这些产品通常在检测完成前注入患者体内。这些短效期产品包括调配无菌制剂(CSP)、正电子发射断层扫描(PET)产品以及细胞和基因疗法产品,它们需要新一代的基于风险的方法,包括快速微生物测试。有关无菌检查以外有助于无菌保证因素的一般讨论,请参见无菌保证〈1211〉。应注意的是,与其他替代测试方法一样,如果发生争议,仲裁采用的测试方法应该符合USP〈71〉所列方法。
如果进行微生物检测,在产品使用前完成检测微生物污染的测试来确保患者的安全。
快速微生物检测(RMTs)应基于风险,这样利益相关者可选择适合其预期用途的首选技术,并平衡用户需求规范(URS),包括出结果时间、特异性、检测限(LOD)、样本量和产品属性。例如,许多**药物,由于**示踪剂的半衰期短,通过实时微生物检测受益最多,而调配无菌制剂(CSPs)和细胞治疗产品,由于会稍微超过使用日期,因此采用通宵检测或至少在48小时内完成检测会使用户受益。
本章节是一般性信息,讨论了生产/制备和检测短效期产品的需求及其URS,并简要讨论了短效期的无菌产品放行的基于风险的快速微生物检测的一些合适方法(本章下文称为"短效期产品")。
2 无菌短效期产品放行的快速微生物测试的用户要求规范
短效期产品放行进行快速微生物测试选择合适的技术应该是基于风险的决定。不同技术的URS包括:
o用尽可能短的时间产生检测结果,是实时的或少于24小时,是在产品给药之前
o检测能力,在测试样品中检测到少于100CFU
o能够在产品中检测多种活性微生物
o样本数量,即测试物品的最小数量和每个测试容器的数量,不会用完大部分的可用产品;
在可行的情况下,制造商应在工艺设计过程中考虑检测要求
o无菌测试材料处理,即封闭系统,以减少测试过程中的意外污染
o可从多个供应商获得仪器和试剂
o参考标准、阴性和阳性对照的可用性,适用于使用菌落形成单位以外信号的技术。
o易于使用/测试和数据解释简单
o假阳性和假阴性结果的发生率较低
o针对每个特定产品的方法适用性测试策略
o提高患者的安全性,主要在于:
在给药前完成测试
提供无菌检测不合格的逐步监测和报告的测试
o能够识别检测到的微生物,这可能对临床医生用药以及调查确定其来源有用。
o测试中使用的设备和试剂的耐用性和可靠性
o样品制备适用于手动和自动方法
3 基于风险的微生物监测和放行测试的概念
对快速微生物检测(RMT)的URS的审查表明,需要做出一些基于风险的决定,特别是在出结果的时间、LOD、样本量以及检测到的微生物范围方面,以便在给药前采用此类检测。如果现行的无菌检查不合适,利益相关者应进行风险评估以选择RMT。
受益的方面可能包括,例如:
o当产品给药太晚对患者生存存在重大风险的情况下使用RMT。临床文献中的一个显著例子是血液感染,这是一种快速进行性感染,死亡率高达40%,并且每天延迟服用抗生素会导致死亡率增加10%。在这些情况下,在给药前完成微生物测试显然可以提高患者的安全性。
o采用生长型的RMT,将连续读数应用于"到目前为止为阴性"的风险放行,因为可以更早地检测到快速生长的微生物,如果检测到不合格,这样让临床医生能够更快地对患者进行干预。当检测到被污染的产品时,实验室主管可以通知治疗患者的临床医生,并可以开始血管内液体复苏和抗生素治疗以避免感染性休克。因此,与培养期结束时的单个读数相比,逐步监测并自动报告不合格的无菌测试具有额外的优势。
o使用LOD高于1 cfu的非生长型RMT,通过微生物培养基中的生长进行扩增,但产生结果的时间非常快。短效期产品在给药之前实时检测污染的能力可能会认为比在产品中检测单个菌落形成单元更重要。当考虑到对患者的风险时,RMT的选择应考虑到检测灵敏度与检测时间的关系。分析应有合理的灵敏度,以检测低水平污染物的存在,并应在产品给药前可获得结果的时间框架内进行。
o非生长型RMT方法的其他优点还可能包括不受测试样品中抗生素的影响,以及检测培养阴性感染因子。一些DNA靶向抗生素(如多粘菌素B和杆菌肽)已被证实抑制了PCR扩增,而青霉素G、氯霉素、两性霉素和纳利地西酸等抗生素不影响反应的分辨能力。这对于生产抗生素注射溶液的无菌配制药房来说是最重要的。方法适用性应确定供试品中是否有抗生素会影响测定。
此外,在最终产品放行无菌检查之前,可将RMTS或其他快速微生物方法(RMMs)用于中控之中,以更快地提供有关微生物控制的有效性和对总污染的早期检测的信息(以便调查和尽快启动生产)或产品可能无菌不合格的可能性。
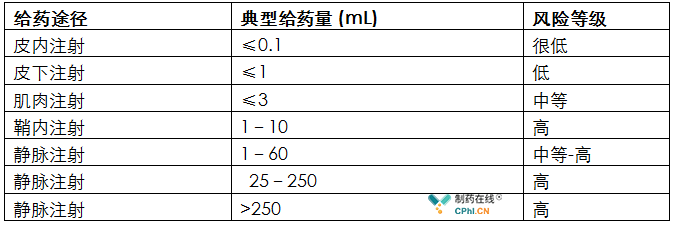
对于风险评估,一个可能被忽视的考虑因素是根据注射或注入的产品的数量和给药部位对病人的相对风险。注入体积越大,侵入性越强,患者的血流感染风险就越大。风险范围从少量的皮内注射到大量的静脉注射(见表1)。
表1. 按给药途径和相对风险水平划分的典型注射量
4 用于确定无菌短效期产品放行的基于风险的快速微生物试验的关键操作参数
预计的操作参数,即表2中列出的适用于RMT的备选技术的LOD、出结果的时间以及样本量。
表2 备选的快速微生物技术的操作参数
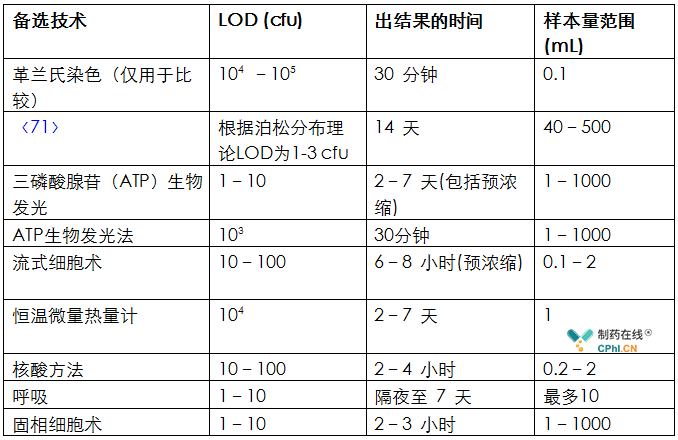
对于这些方法,信号将以基因组单位表示。
5 〈71〉不适用于产品放行检测时样本大小的考虑
根据技术的样品处理能力或保存急需产品的需要,可能需要缩减样本大小。
每种培养基所使用的产品的最小数量以及与批量相关的待测单元的最小数量见< 71 >,表2和表3。人们普遍认为,对于大批量的制药产品,检测的单位数量并不是基于统计的,而且在每个产品批次中检测低污染水平的能力较低。然而,随着许多效期较短的产品的批量变小,这一限制将会减少,因为测试的产品相对于批量的比例将会增加。
这种传统的取样计划不适用于细胞治疗产品。例如,如果准备了10个单独的60毫升的静脉注射(IV)细胞袋,那么将取4个样品袋,每个样品袋取20毫升。采用这种抽样方案,40%的批次将被用于无菌检查,这不仅是巨大的经济损失,而且更重要的是,治疗产品的巨大损失,可能会影响对患者的足量给药剂量。相反,如果40个1毫升的西林瓶用于注射用药品4万瓶批次的无菌检查,这只占该批次的0.1%。
减少样本量和检测单位数量将降低无菌检查的灵敏性。表3和表4说明了对药品和调配无菌制剂(CSP)测试的相对不敏感性。
表3 药品20单位的无菌检查通过给定的不断增加的污染率的概率
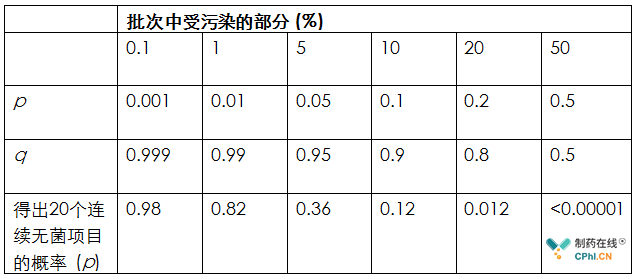
根据以下进行计算
p = (1 - p)20 = q20
p = 批次中污染的比例
q = 批次中未污染的比例
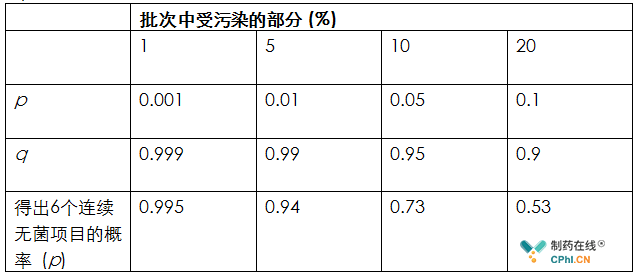
表4 无菌调配制剂(CSP)6单位的无菌检查通过给定的不断增加的污染率的概率
其他药典中也提出了替代的抽样计划。欧洲药典9.0章第2.6.27细胞制剂微生物学检查中发现了一种批量小于40个单位的细胞治疗产品无菌检查的推荐方法。
容量在10 ~ 1000ml的细胞制剂的污染试验样品量为总容量的1%;容量在1 ~ 10ml的细胞制剂,样品量为0.1 mL;对于小于1ml的细胞制剂,该制剂将不进行检测。如21 CFR 610.12(无菌)中所建议的,在完全合理的情况下,可使用快速方法进行中控检测,以代替最终产品检测。
与细胞治疗制剂类似,PET**药物的样品量和采样计划也必须适应有限的瓶数(通常为一个)和批次中生产的产品容量(通常小于15毫升)。如果该批次由单个容器组成,则无菌检查样品量至少为该批次总容量的1%。例如,如果一个批次是1瓶含有15毫升,至少使用0.15毫升用于无菌检查。如果该批次由多个容器组成,则使用单个容器的量至少占整个批次容量的1%。如果每批由3个小瓶组成,每个小瓶含有25毫升,则至少从1小瓶中取0.75毫升用于无菌检查。
检测限
在用一个或多个菌落形成单元的细胞悬浮液制备接种物的限制条件下,生长型的无菌检查显示根据泊松分布理论检出限至少为1-3 cfu。对所有技术设置单个活细胞的LOD,对于任何无菌检查方法来说都是设置了不切实际的使用障碍,尤其是当信号不是通过培养的浓缩而放大的菌落形成单元时。
检测多种微生物的能力
尽管所有的分析平台都应能够检测各种各样的细菌、酵母菌和霉菌,但证实快速微生物检测(RMT)选择的技术能够检测与无菌检查不合格、爆发感染以及与CSP、**药物、细胞疗法或制剂相关的产品召回有关的微生物,这一点是非常重要的。风险分析后,如果该技术显示能够通过向独立利益相关患者给药,并提高患者的安全性,则情况尤其如此。
6 无菌短效期产品放行快速微生物检测方法
根据与上文讨论的URS的匹配情况,适用于RMT推荐的技术,按字母顺序列出如下:
o三磷酸腺苷(ATP)生物发光
o流式细胞术
o恒温微量热量测定法
o核酸扩增
o呼吸
o固相细胞术
技术简介
分别对这些备选的高级分析平台进行了简要讨论,并提供了关键参考。有关概述,请参阅Moldenhauer
三磷酸腺苷生物发光
这是一项成熟的技术,有多种仪器制造商提供的光度计和试剂。活细胞的能量以ATP的形式储存,当接触美国萤火虫的荧光素酶时,可以以光的形式测量。荧光素酶消耗的每个ATP分子产生一个光子。
光度计检测到的结果通常以相对光单位(RLU)表示,并且结果依赖仪器、试剂和有机体。不同微生物的ATP含量范围为革兰氏阴性菌2~4×10~18摩尔/cfu,革兰氏阳性菌5~8×10~18摩尔/cfu,真菌300~800×10~18摩尔/cfu。在微生物培养基中,由于测量的高信噪比和背景ATP,肉汤中微生物相关仪器的检测限约为5000 RLU,相当于约10 3 CFU。
这一LOD将检测微生物的存在,其水平与目视检测培养基生长所需的水平相比,低3-4个对数水平。无菌短效期产品放行的快速微生物试验,无论是在液体培养基中达到阈值ATP水平的浓缩培养,还是在固体培养基上的膜过滤器上形成微生物菌落的浓缩培养,培养时间均可达到2-7天。
流式细胞术
流式细胞术可用于在24-48 h的浓缩培养后检测荧光标记的活菌细胞。标记试剂由荧光基质或活菌染色剂组成,用于区分活细胞与死细胞和细胞碎片。虽然细菌非常小,可能很难从细胞碎片中区分出来,但它们可以通过大小、形状和荧光强度来区分。细胞存活能力是指完整的细胞膜保留由非特异性细胞酯酶产生的荧光色素的能力,或用核酸特异性生命染色标记细胞。激光照射流中的每个细胞以及发出的光由双光电倍增管阵列检测。信号经过数字化处理,并由识别软件进行解释。该技术的LOD可能是>1 cfu并且可能需要一个浓缩步骤。
恒温微热量计
恒温微热量计监测与微生物代谢活性和生长有关的密闭小瓶(系统)的焓变化。利用现有的仪器,104个活性微生物细胞可以释放足够的热量进行检测并且检测需要浓缩(出结果需2-7天)。尽管其在无菌产品放行测试中的具体应用尚未确定,但最近它在药物微生物学中的应用已经得到了评估。
核酸扩增技术
实时定量聚合酶链反应(PCR)有可能通过36-48个扩增周期监测PCR的指数阶段,使用通用引物和探针(称为"泛细菌"和"泛真菌"方法)估计目标DNA的初始数量,即反过来,与试验样品中微生物细胞的数量成比例。与DNA不同的是,细胞RNA的代谢速度很快,可以更好地指示活的微生物。
例如,大肠杆菌每个细胞含有2个DNA分子和2×104个16S rRNA分子。这一过程是通过酶逆转录酶将RNA转化为DNA(cDNA)的互补拷贝来实现的,cDNA可以通过定量(计数试验)或定性(无菌检查)实时分析。或者,对于基于DNA的PCR,用单叠氮化物或单叠氮化物丙啶预处理的样品也可以提供区分活的和死的微生物细胞的能力,或者可以通过离心/洗涤步骤从试验样品中去除游离的微生物DNA,包括从分析用细菌颗粒中去除游离的微生物DNA。
实际上,单个活细胞的LOD可能是一个不可克服的挑战,尤其是对于依赖DNA/RNA靶和通用性引物的测试而言。
另一个挑战是不同微生物中不同数量的基因组物质。
一般情况下,LOD在样本中范围为10到1000个活细胞/mL,另外在一些报告病例中范围为10到100个活细胞/mL。最近的研究表明,PCR实际上可以在不需要在微生物生长培养基中预培养的情况下,在含有高达10个哺乳动物细胞/mL的高浓度样品中检测到10 - 10 cfu/mL的微生物。增加生长型的浓缩步骤至少24-48 h并且比较培养前后PCR结果,可为无菌检查提供实用的解决方案。
另外,还可以采用浓度法来富集样品,减少样本体积。如上所述的最近的一项研究的作者使用16 s rRNA PCR对干细胞进行无菌检查,证明细菌灵敏度为10 - 100 cfu / mL,测试方法灵敏度100 cfu /毫升将适合检测临床显著细菌污染的血液和细胞制品。
生长型和核酸扩增型检测方法的直接比较是复杂的,因为核酸扩增型检测方法也检测非活性的生物体,而且是对微生物基因组拷贝数的测量,而不是菌落形成单位。因此,核酸扩增型检测LOD应根据每毫升基因组当量来定义。
用于无菌短效期产品(如核酸扩增)放行的非生长型RMT由于以下原因可能具有其他优势:
o接近实时的检测,将在短效期产品注入患者体内前完成检测
o检测培养阴性感染因子
o如本章前面所述,测试样本中抗生素对测试的影响最小
o与其他技术相比,该测试对动物细胞裂解(如颗粒、ATP)产生的背景不太敏感,因为特定的微生物基因是靶向的
呼吸类技术
这一大类包括从经典呼吸计,到气体顶空分析仪,再到自动血液培养系统。好氧和厌氧肉汤配方考虑到了5天的培养时间内可以回收引起血流感染的大多数微生物的回收率。在一些仪器中,这包括如〈71〉中20°-25°和30°-35°的培养。这项技术已经成功地扩展到细胞治疗产品的无菌检查,采用7天的培养作为批次放行药典无菌检查的替代方法。
其他可用于检测和计数呼吸微生物的仪器。例如,可调谐二极管激光吸收光谱(TDLAS)可以测量培养基中含有生长微生物的封闭单元中的氧(O)消耗或二氧化碳(CO)增加。该技术最初是为监测密闭装置中的气体顶空成分而开发的,也可用于自动介质填充检查。系统具有气体校准标准,如果系统用于无菌检查(例如,对大容量容器进行校准),则需要进行较小的调整。
[注:呼吸平台的所有系统都需要微生物生长和代谢活性进行检测,即通常需要2-7天的时间才能获得结果。但是,如果结果可以逐步监测,在培养期间早先检测到无菌检查不合格,这对于上述风险评估部分所述的短效期产品是一个巨大的优势。]
固相细胞术
有基于固相细胞术的仪器系统,结合荧光标记和固相激光扫描,可快速计数可过滤液体中的活微生物。通过过滤0.45微米聚酯膜收集微生物,并用背景和活性染料进行处理。用高速488nm氩激光在细胞仪中扫描滤光片。多个光电倍增管,经过处理以区分标记微生物和背景噪声,根据大小、形状和荧光强度,检测荧光。扫描显示为一张地图,用于识别荧光事件的位置,使用带自动机动化台的表观荧光显微镜来确定单个事件的位置。该系统声称能在2-3小时内检测到单个的活微生物。应该注意的是,大多数细胞治疗产品都是不可过滤的,因此该技术可能与这些类型的产品不兼容。
7 方法适用性测试
生长型无菌试验的方法适用性要求见〈71〉。必须要证明每个待测试产品的测试适用性。在残留产品存在的情况下,USP在低于100 cfu的水平上挑战生物体的回收率,被证明为直接接种或膜过滤法的微生物生长介质中明显可见生长。除了源自实验室的菌落形成单元以外的信号培养(例如,核酸、ATP和活微生物细胞的荧光标记),测试实际样品的结果可能会得出与使用其他技术不相同的结果。然而,方法适用性测试将确认分析物中的产品残留物不会抑制与快速方法产生信号相关的酶促步骤。
8-术语(省略)
9-参考文献(省略)
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57