8月22日,恒瑞发布公告称,海曲泊帕乙醇胺符合药品注册的有关要求,获NMPA批准开展临床试验,用于肿瘤化疗所致血小板减少症(CIT)适应症。

(资料来源:CDE)
海曲泊帕属于TPO-R激动剂,可以说是诺华艾曲泊帕的me-better(具体疗效比较需要上市后才有确切定论),或称为恒瑞下一个申请上市的1类新药。
全球共有4款TPO-R激动剂上市
血小板是血液中与血液凝固息息相关的细胞,而血小板减少症不仅是指血小板数目不足的疾病,还包含了血小板无法发挥正常功能的疾病,主要有特发性血小板减少紫癜症(ITP)、慢性肝病成人患者的血小板减少症(CLD)、血栓性血小板减少紫癜症、后天血小板功能缺乏症等。其中,ITP、CLD属于较严重的血小板减少症,具有较高的自发性出血,甚至可以危及生命。
血小板生成素受体(TPO-R)激动剂是目前欧美国家对血小板减少症的常规治疗药物。目前,全球已经上市的TPO-R类药物共有4个,分别是盐野义的芦曲泊帕、诺华的艾曲泊帕(从GSK获得)、安进的罗米司亭以及三生制药的血小板生成素。
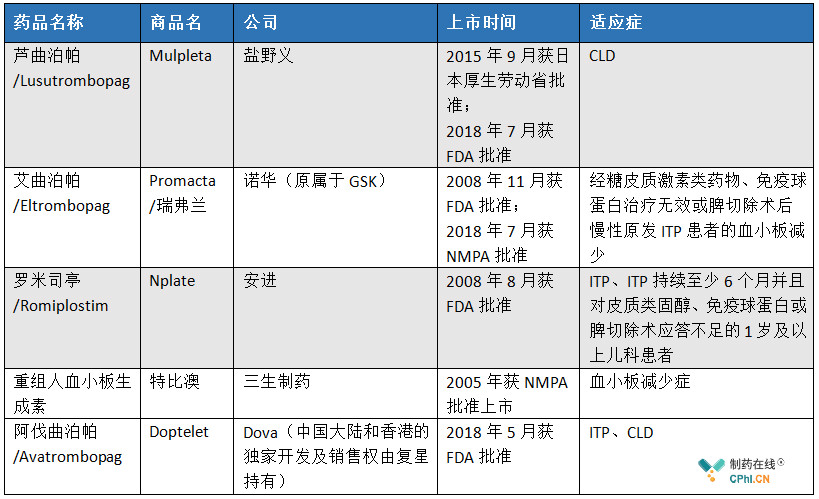
(根据公开资料整理)
艾曲泊帕(Eltrombopag,商品名:Promacta/瑞弗兰)是GSK研发的非肽类TPO-R激动剂,最早于2008年获FDA批准上市,目前该品种已在全球100多个国家批准上市。2018年7月21日,诺华中国宣布艾曲泊帕在中国获批上市,商品名为瑞弗兰,用于特发性血小板减少性紫癜(ITP)患者。经查询IMS数据库,2018年艾曲泊帕全球总销售额约为102,650万美元,国内销售额约为277万美元。
阿伐曲泊帕(Avatrombopag,商品名:DOPTELET)是复星从Dova获得的品种。2018年3月,复星与Dova达成最终协议,获得阿伐曲泊帕在中国大陆和中国香港的独家开发及销售权。根据协议,复星将向Dova支付首付款、里程金以及固定金额的转移供货费用,复星有权独家协助Dova在中国大陆和中国香港开发阿伐曲泊帕用于治疗慢性肝病患者的血小板减少症(CLD)。此外,复星还将支持开发阿伐曲泊帕在中国大陆和中国香港用于其他适应症。2019年6月,阿伐曲泊帕获NMPA批准用于治疗肿瘤化疗引起的血小板减少症(CIT)的临床试验,将在中国(不包括中国港澳台地区)开展临床III期。
艾曲泊帕的me-better
海曲泊帕是口服吸收的小分子非肽类TPO-R激动剂。海曲泊帕是在艾曲泊帕结构上进行了一系列修饰得到的具有自主知识产权的高选择性TPO-R激动剂。
恒瑞于2011年5月首次申请海曲泊帕的临床,2019年6月再次申请临床,具体申请信息如下:
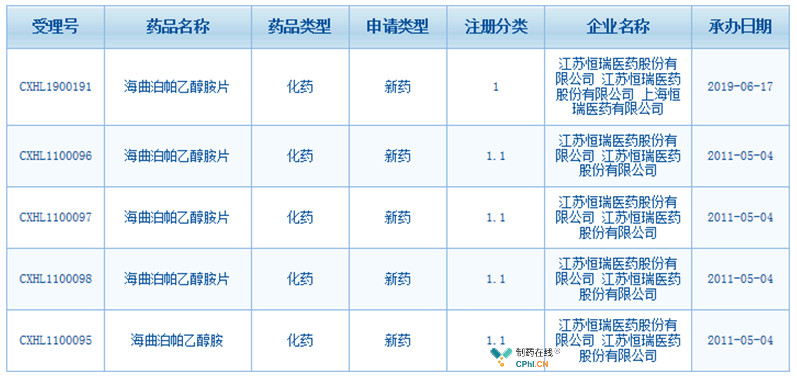
(资料来源:CDE)
笔者在"药物临床试验登记与信息公示平台"上,查到海曲泊帕共开展了以下临床试验,其中用于原发免疫性血小板减少症的临床试验已经正式开展Ⅲ期临床。
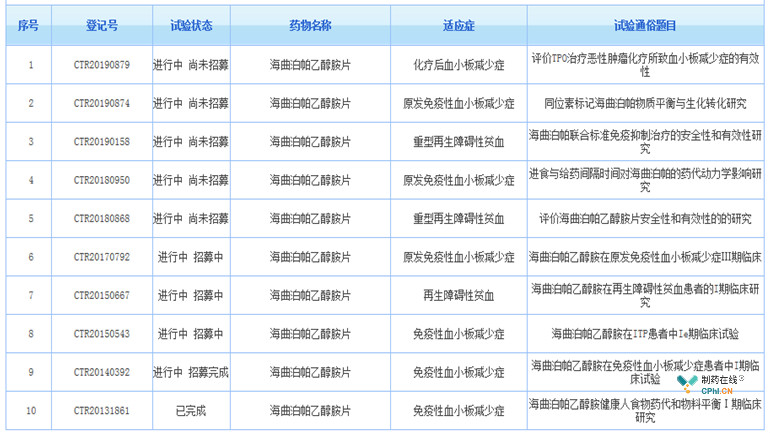
(资料来源:药物临床试验登记与信息公示平台)
市场潜力较大
血小板减少症是一种出血性疾病。严重性血小板减少症如CLD、ITP患者具有较高的自发性出血,更严重者甚至可以危及生命,而肿瘤化疗导致的血小板减少症的发生可导致化疗疗效降低,是临床常见的化疗药物剂量限制性**反应。目前血小板输注、糖皮质激素和第一代人重组全长血小板生成素是国内临床相关疾病的主要治疗手段。第二代TPO-R激动剂的出现是对现有治疗方案的一种有益补充。
根据IMSHealth提供的资料,截至2016年12月,在中国,针对特发性血小板减少性紫癜和肿瘤化疗引起的血小板减少症的治疗药物中,第一代人重组全长血小板生成素(商品名:特比澳)于样本医院的销售额约为人民币6.76亿元。全球市场,针对特发性血小板减少适应症,第二代TPO-R激动剂销售额约12.6亿美元。
仿制药也在积极研发中
值得一提的是,除了原创新药,国内有些药企也在开展已上市TPO-R激动剂仿制药的临床研究,比如齐鲁制药的QL0911,QL0911全称是注射用重组人血小板生成素拟肽-Fc融合蛋白,是罗米司亭的生物类似药,目前正在开展Ⅰ期临床。
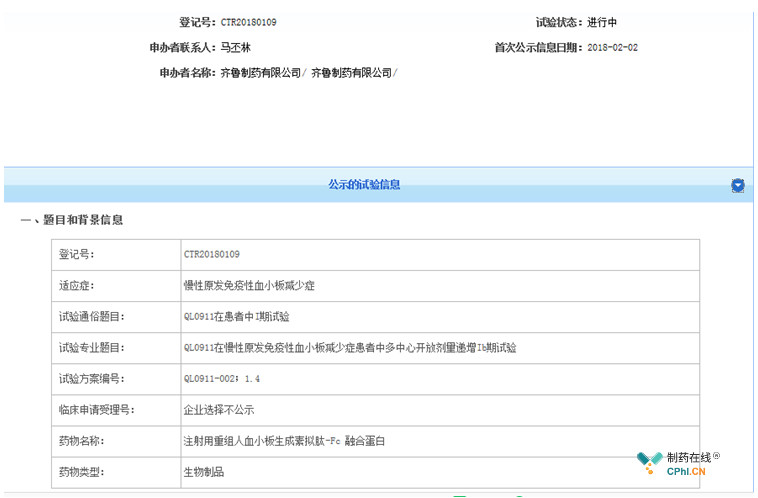
(资料来源:药物临床试验登记与信息公示平台)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57