2019年8月,国产药品中,共有13个1类化药和11个1类生物制品获批临床,这些新药靶点覆盖PD-1、PD-L1、 JAK、 BTK、IDH1/2、PCSK9、IL-17A等多个热门靶点,笔者将详细为您解说。
1类化药临床审批概况
2019年8月,共有12个中国1类化药获得NMPA的临床试验默示许可,具体信息如下表所示:
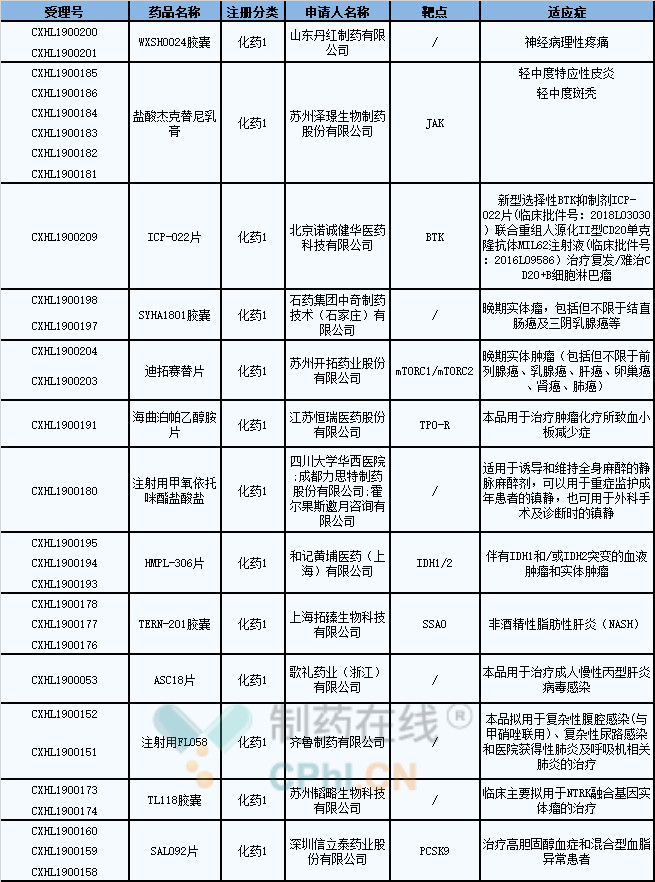
(资料来源:CDE)
1、WXSH0024胶囊
WXSH0024由步长制药子公司山东丹红制药研发,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗神经病理性疼痛。
2、盐酸杰克替尼乳膏
盐酸杰克替尼乳膏由苏州泽璟生物研发,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验。
盐酸杰克替尼乳膏是首个JAK抑制剂的外用乳膏剂型,用于治疗轻中度特应性皮炎和轻中度斑秃,这也是继辉瑞的PF-06651600之后,国内第二款获批临床的斑秃治疗新药。杰克替尼属于氘代JAK抑制剂,氘代原研药是吉利德的Momelotinib(代号:CYT387),专利于2035年到期。
日前,央视财经有报道称,全球范围内大约有1.47亿斑秃患者,中国大约有400万。但与巨大患者人群不匹配的是,目前为止并没有治疗斑秃的通用疗法,FDA也没有批准任何治疗斑秃的药物。
泽璟制药被认为是继Concert与Auspex(2015年被仿制药巨头TEVA收购)之后的全球第三大氘代药物公司。2019年6月10日,上交所受理泽璟生物的科创板上市申请。泽璟是科创板申报以来,第一家采用"第五套上市标准"进行申报的公司。
3、ICP-022片
ICP-022是诺诚健华具有全球自主知识产权的1类创新药,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,联合重组人源化II型CD20单克隆抗体MIL62注射液治疗复发/难治CD20+B细胞淋巴瘤。2019年5月通过FDA临床审评,将在美国开展临床研究,是诺诚健华首个在美国开展临床试验的创新药物。
ICP-022是具特异选择性的BTK抑制剂,用于治疗肿瘤及自身免疫性疾病,目前在中国开展多中心、多适应症的临床II期研究,初步结果显示了良好的安全性和疗效。
4、SYHA1801胶囊
SYHA1801是石药研发的新型小分子激酶抑制剂,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗晚期实体瘤。
临床前研究显示,该产品具有优异的体内外抗肿瘤活性和良好的安全性,极有希望在临床研究中展现出良好的抗癌治疗效果,目前全球尚无同类产品上市。
5、迪拓赛替片
迪拓赛替由开拓药业研发,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗晚期实体肿瘤。
迪拓赛替为新型mTORC1/mTORC2抑制剂。PI3K/AKT/mTOR信号通路参与细胞增殖、分化、凋亡和营养等多种细胞功能的调节,是肿瘤细胞中最常见的被激活的致癌信号通路,并在临床上被证明是多种癌症产生耐药性或转移的重要机制。根据开拓药业公告,目前在全球范围内尚未有第二代mTOR抑制剂上市。
6、海曲泊帕乙醇胺片
海曲泊帕乙醇胺是恒瑞研发的1类新药,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗肿瘤化疗所致血小板减少症。
海曲泊帕乙醇胺是一种口服吸收的小分子非肽类促血小板生成素受体(TPO-R)激动剂,是在艾曲泊帕(商品名:Promacta/瑞弗兰)结构上进行了一系列修饰得到的具有自主知识产权的高选择性TPO-R激动剂。恒瑞于2011年5月首次申请海曲泊帕乙醇胺的临床,2019年6月再次申请临床,该品种可能成为恒瑞下一个申报上市的药物。
目前,全球共有4个TPO-R激动剂TPO-RA类药物上市。
7、注射用甲氧依托咪酯盐酸盐
甲氧依托咪酯由力思特研发,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验。
甲氧依托咪酯属于咪唑类短效静脉全身**药。其分子结构与依托咪酯相似,仅针对依托咪酯的酯侧链进行修饰,保留了依托咪酯的优点(起效迅速、恢复迅速、治疗指数大、循环稳定、对呼吸系统影响小),相对于依托咪酯对肾上腺皮质抑制作用较轻,兼具依托咪酯和丙泊酚的优点。该产品适用于全身**的诱导,也可用于短小外科手术及诊断性检查时的镇静或用于重症监护患者的镇静。
8、HMPL-306片
HMPL-306由和记黄埔研发,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗伴有IDH1和/或IDH2突变的血液肿瘤和实体肿瘤。
HMPL-306是一种新型小分子异柠檬酸脱氢酶-1/2(IDH1/2)抑制剂,目前全球仅有两款靶向IDH新药获得FDA批准,均用于治疗白血病。首款IDH2抑制剂Enasidenib由Agios Pharmaceuticals与新基研发,于2017年8月被FDA批准治疗IDH2突变患者的复发性AML。首款IDH1抑制剂Ivosidenib也是由Agios Pharmaceuticals开发,于2018年7月获得FDA批准治疗携带易感IDH1突变的成人复发或难治性急性髓系白血病(R/R AML)。
中国目前尚无靶向IDH抑制剂获批上市。2019年7月,Agios Pharmaceuticals合作伙伴基石宣布IDH1抑制剂Ivosidenib在中国启动注册性I期试验获批,治疗携带IDH1基因突变的R/R AML患者。
9、TERN-201胶囊
TERN-201由拓臻生物研发,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗非酒精性脂肪性肝炎(NASH)。
TERN-201属于氨基脲敏感胺氧化酶(SSAO)抑制剂,最初由礼来研发,2018年,拓臻与礼来签订开发、制造和商业化TERN-201治疗NASH的全球独家协议。在2019上半年于维也纳举行的国际肝 脏大会(International Liver Congress?2019)上,拓臻生物发表了TERN-201临床前研究数据,显示其在NASH啮齿类动物模型中显著改善肝 脏NAS评分和纤维化。
非酒精性脂肪性肝炎(NASH)是非酒精性脂肪肝病(NAFLD)的重症类型,由肝 脏中脂肪过量堆积所致。NASH与慢性肝 脏炎症和肝细胞损伤有关,可导致纤维化、肝硬化,最终导致肝癌或肝功能衰竭。全球NAFLD和NASH发生率正快速上升,与肥胖发生率攀升有关。目前全球还没有获批用于治疗NASH的药物。
10、ASC18片
ASC18由歌礼研发,是歌礼第4个治疗丙肝的药物,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验。
歌礼的第1个丙肝药达诺瑞韦(商品名:戈诺卫)于2018年6月获批上市,第2个丙肝药拉维达韦上市申请于2018年8月被纳入优先审评,第3个丙肝药ASC21于2019年3月获批临床。
11、注射用FL058
FL058由齐鲁制药研发,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗复杂性腹腔感染(与甲硝唑联用)、复杂性尿路感染和医院获得性肺炎及呼吸机相关肺炎。
12、TL118胶囊
TL118由苏州韬略研发,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗NTRK融合基因实体瘤。
TRK基因融合是一种染色体改变,当NTRK1/2/3这3种基因与其他基因发生融合时,就会导致构象异常的TRK蛋白(TRKA、TRKB、TKRC)产生,激活特定类型肿瘤细胞增殖相关的信号通路,进而诱发NTRK基因融合的恶性肿瘤。NTRK基因融合的发生与肿瘤的发病位置无关,与年龄无关,可见于多种实体瘤类型中,包括胰 腺癌、甲状腺癌、唾液腺癌、乳腺癌、结直肠癌、肺癌等。
目前,全球上市的同样用于治疗NTRK融合基因实体瘤的药物有两个,分别是拜耳/LOXO的拉罗替尼(2018年11月被FDA批准上市)以及罗氏的恩曲替尼(2019年8月被FDA批准上市)。
13、SAL092片
SAL092是信立泰研发的小分子PCSK9抑制剂,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗高胆固醇血症和混合型血脂异常患者。
值得一提的是,信立泰的SAL092属于小分子抑制剂,与其他药企研发的PCSK9单抗相比较,具备价格优势。
PCSK9(前蛋白转化酶枯草溶菌素9)是一种神经细胞凋亡调节转化酶,不但参与肝 脏再生,调节神经细胞凋亡,还能通过降低肝细胞上LDLR的数量,影响 LDL内化,使血液中LDL不能清除,从而导致高胆固醇血症。研究表明,PCSK9水平与胆固醇、ox-LDL、甘油三酯显著相关,是他汀类药物之后公认的最有效的降脂靶点。
全球目前共批准上市了2款PCSK9抑制剂,分别是安进的Repatha和赛诺菲/再生元的Praluent。
1类生物药临床审批概况
2019年8月,共有11个中国1类生物药获得NMPA的临床试验默示许可,具体信息如下表所示:
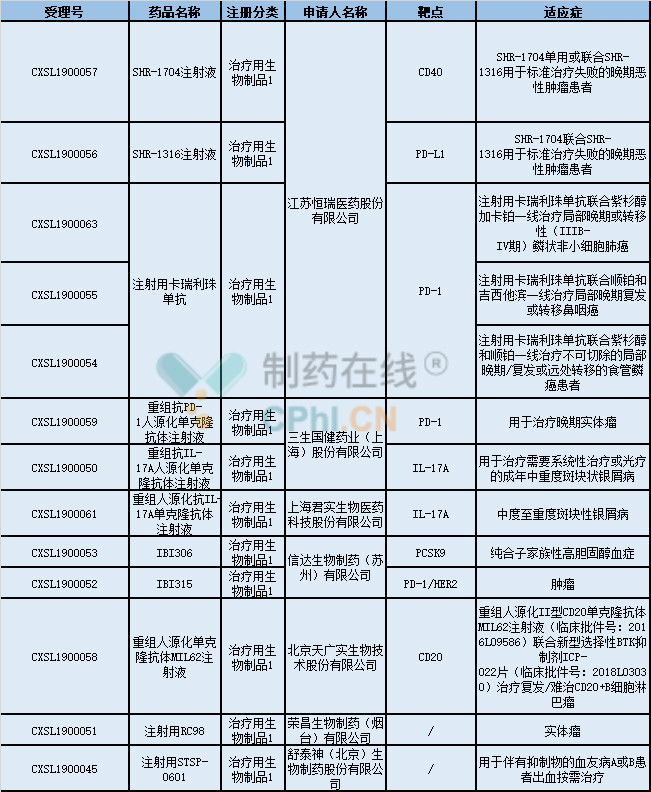
(资料来源:CDE)
1、SHR-1704注射液
SHR-1704属于CD40单抗。CD40是一种关键的免疫共刺激受体,存在于免疫系统中抗原提呈细胞(APC)的表面,在先天性免疫系统和适应性免疫系统机制的激活中起着关键作用,被认为是免疫肿瘤学中一个新颖的靶点。
国内同靶点在研的有诺华的全人源单抗Iscalimab,Iscalimab通过阻止CD40通路信号传导和CD40+细胞类型的激活,有望成为治疗实体器官和相关自身免疫疾病的新疗法。在国内已获批临床,用于治疗系统性红斑狼疮、狼疮性肾炎。
2、SHR-1316注射液
SHR-1316是PD-L1单抗,除了恒瑞,科伦、复星等也在布局,目前国内尚无PD-L1上市。
3、注射用卡瑞利珠单抗和重组抗PD-1人源化单克隆抗体注射液
卡瑞利珠属于PD-1单抗,于2019年5月获批上市,此次是申请鳞状非小细胞肺癌、鼻咽癌以及食管鳞癌患者的一线治疗,关于这个的研究报道太多,笔者不再赘述。
重组抗PD-1人源化单克隆抗体注射液是三生国健研发的PD-1单抗,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗晚期实体瘤。
4、重组抗IL-17A人源化单克隆抗体注射液和重组人源化抗IL-17A单克隆抗体注射液
这两款药物分别由三生国健和上海君实研发,分别于2019年5月、6向NMPA递交临床试验申请,2019年8月被默认许可临床试验。
IL-17A属于白介素 -17(Interleukin-17,IL-17)家族的一种,在促进银屑病、银屑病关节炎和强直性脊柱炎(AS)等疾病的自身免疫反应中的炎症状态起重要作用。全球目前有2款IL-17A单抗上市,分别是诺华的Secukinumab(商品名:Cosentyx)和礼来的Ixekizumab(商品名:Taltz)。
Secukinumab是全球首个上市的IL-17A单抗,于2015年1月获FDA批准上市,2019年4月获NMPA批准,2018年销售额接近30亿美元,获批适应症有斑块状银屑病、银屑病关节炎、头皮银屑病、脓疱型银屑病、强直性脊柱炎等。Ixekizumab于2016年3月获FDA批准,2018年销售额为9.38亿美元,已获批适应症包括斑块状银屑病、银屑病关节炎、脓疱型银屑病、红皮病型银屑病等。
5、IBI306
IBI306是信达生物研发的PCSK9单抗,于2019年6月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗纯合子家族性高胆固醇血症。
6、IBI315
IBI315是国内首个PD-1/HER2双特异性抗体,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,该品种是信达与韩美药业合作的项目。
7、重组人源化单克隆抗体MIL62注射液
MIL62由北京天广实生物研发,是利妥昔单抗与阿托珠单抗的优效产品(me-better)。MIL62是岩藻糖敲除的第三代aCD20抗体,体外药效学证明有效于进口产品美罗华,岩藻糖敲除,优于GA101仅50%敲除水平。此次临床试验申请是联合北京诺诚健华的BTK抑制剂ICP-022片,治疗复发/难治CD20+B细胞淋巴瘤,具体信息见上文。
8、注射用RC98
RC98由荣昌生物研发,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于治疗实体瘤。
9、注射用STSP-0601
STSP-0601是舒泰神研发的凝血因子X激活剂,于2019年5月向NMPA递交临床试验申请,2019年8月被默认许可临床试验,用于伴有抑制物的血友病A或B患者出血按需治疗。
STSP-0601可以特异性地激活FX,使活性部位充分暴露生成FXa,FXa进而与损伤部位激活的血小板、FVa以及钙离子形成凝血酶原复合物,从而增加凝血酶生成量达到出血患者止血的目的。
作者简介:菜菜,上海交通大学药学硕士,曾工作于科学技术情报研究所,现为药监系统从业人员,擅长解读行业法规、最新药研动态等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57