
在2017-2018年间,美国FDA先后发布《使用真实世界证据以支持医疗器械监管决策》、《临床研究中使用电子健康档案数据指南》和《真实世界证据计划的框架》等文件,打开了制药行业和医疗器械行业研发和注册领域的新通道。2019年5月,FDA发布指南《Submitting Documents Using Real-World Data and Real-World Evidence to FDA for Drugs and Biologics》,此指南引发行业关注和讨论,并进而让业界人士开始审视过去漫长现实世界的知识、信息、数据和文献,并开始被发掘以支持药品和医疗器械的法规申报。
根据FDA2019年5月技术指南,真实世界数据(RWD)包括:来自电子监控记录的数据;医疗说明和表格数据;产品和疾病登记机构的数据;患者治疗产生的数据,包括在家治疗或者在其他分散诊所治疗产生的数据;来自其他可以提供健康咨询的数据,例如移动健康器械等。同样,根据FDA指南,真实世界证据(RWE)指的是:RWE是关于通过RWD分析而得出的医疗产品的用途、潜在利益或风险的临床证据。
在美国FDA发布相关技术指南后,世界各国药政机构立即给与了高度关注,同时也引发制药行业和医疗器械行业的重视和热议。在2020年5月18日,中国NMPA的CDE发文《真实世界证据支持儿童药物研发与审评的技术指导原则(征求意见稿)》,再次引发制药行业关注。同时,制药行业诸多技术人员在深思,是否真实世界证据还有更多待拓展的应用空间。本文汇总相关信息,为各位介绍真实世界证据(RWE)在中国制药行业的应用情况。
第一部分:中国官方发布涉及真实世界证据法规介绍
在2019年5月,FDA发布涉及真实世界证据(RWE)指南后,中国药政官方陆续发布相关文件,汇总介绍如下:
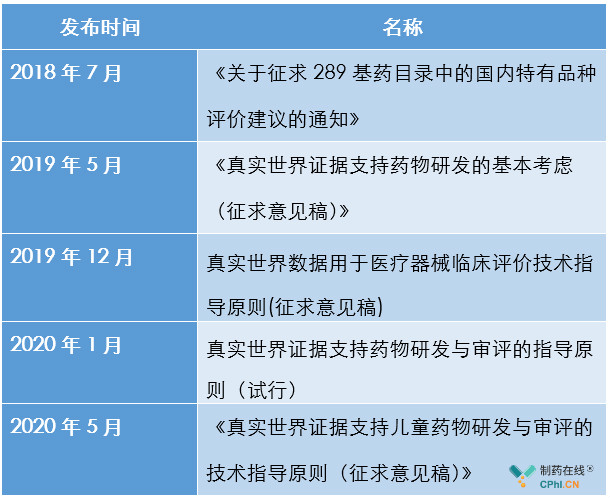
第二部分:真实世界证据对相关产品影响分析
1.1- 依据真实世界证据获批产品介绍
A-美国艾尔建公司"青光眼引流管"
2020年3月,NMPA发布《我国首个使用境内真实世界数据的医疗器械产品获批上市》,其中提到:探索将临床真实世界数据用于医疗器械产品注册,2019年6月,国家药监局与海南省政府联合启动了海南临床真实世界数据应用试点工作。该产品是试点的第一个产品,在注册中使用了在海南博鳌乐城先行区收集的临床真实世界证据进行人种差异评价,为国内首个通过该途径获批的产品。
B-石药集团欧意药业的玄宁
石药集团的玄宁(马来酸左旋氨氯地平片)最早于2003年在国内上市,之后积累了大量的临床数据。 2013-2017年,石药参与国家十二五重大新药科技重大专项LEADER研究-研究马来酸左旋氨氯地平与苯磺酸氨氯地平在高血压治疗中的比较效果。 据悉,项目样本量高达10000 余例。
在2019年底,石药集团的玄宁产品获得美国FDA批准,以NDA身份登陆美国市场。依赖的就是过去多年在中国市场积累的大量真实世界证据。
C-甲状腺片
在《关于征求289基药目录中的国内特有品种评价建议的通知》,CDE提到:甲状腺片疗效确切,不需要进行临床试验或者生物等效性试验,但是需要在后续临床使用过程中收集和补充真实世界证据,来支持药品的临床应用。
1.2- 哪些产品将会大量使用真实世界证据
A- 中药产品
中药产品具有悠久的使用历史和经验,安全性和疗效具有广泛认可的现实基础。而同时,中药产品的经验和数据多来自人类现实实践,不是来自严格设计和监管的临床试验。这样两难的现实,导致很多有较好治疗效果的中药产品,不能被积极应用和推广。
现在,根据中国药政部门发布的指导原则,真实世界证据可用于支持名老中医经验方、中药医疗机构制剂的人用经验总结与临床研发。指导原则指出:对于名老中医经验方、中药医疗机构制剂等已有人用经验药物的临床研发,在处方固定、生产工艺路线基本成型的基础上,可尝试将真实世界研究与随机临床试验相结合,探索临床研发的新路径。
毫无疑问,随着中药产品真实世界证据的规范整理和发掘,会有很多临床有价值,安全有保证的药品实现价值提升。
B- 罕见疾病研发领域
不管是国外药品研发领域,还是国内药品研发领域,对于罕见病治疗用药的开发,都会遇到患者入组少、入组困难、开发成本过高导致项目进展缓慢的现实困境。传统的临床试验需要一个试验组和一个对照组。针对某些罕见病的临床试验,由于病例稀少导致招募困难;针对某些缺乏有效治疗措施的危及生命的重大疾病,随机对照试验往往存在伦理问题。
针对上述罕见病研发领域的现实困难,真实世界证据是一个不错的候选手段。根据NMPA指导原则"真实世界证据支持药物监管决策"部分明确指出,常见的为新药注册上市提供有效性和安全性证据的真实世界研究有:使用真实世界数据获得的结局或安全性数据的随机临床试验,包括实用临床试验(PCT,介于RCT和观察性研究之间的一种研究)设计等;以及针对某些缺乏有效治疗措施的罕见病和危及生命的重大疾病,而采用基于真实世界证据作为外部对照的单臂临床试验。
可以说,这些法规新的改革和调整,无疑会大大减少药企的研发成本,加快罕见病新药在国内的注册上市,并进而为身处疾病折磨的患者提供希望。
C- 儿科用药
与上面提到的罕见病药物开发难度类似,药物研发人员在设计和执行以儿童为受试者的临床研究面临更多困难与挑战,使得试验难以开展或进展缓慢,因此,按照传统临床试验的设计和研究方法,严重影响了儿童药物的临床可及性以及获得足以评估儿童剂量合理性的数据。这也正是目前全球所共同面临的儿童药品短缺与超说明书用药的重要原因之一。
现在官方积极进行法规改革和探索,鼓励企业积极应用真实世界研究的方法获得可靠数据,并形成用于支持监管决策的证据是诸多新方法和新技术中的一种,为儿童新药研发、扩展儿童适应症、完善儿童用药剂量等提供支持。我们希望更多药品研发企业积极行动,为哪些被病魔折磨的儿童患者尽快送去通往健康之路的希望。
1.3- 采用真实世界证据失败的产品案例
Correvio 医药公司心脏复律药 vernakalant在欧盟已经上市十余年,但是在美国开展临床期间导致一名患者死亡进而被FDA暂停或终止临床试验。经过漫长的博弈和解释,在2019年12月,Correvio 医药公司试图将心脏复律药 vernakalant再次提交NDA申请,但是被FDA专家委员会否决。这个案例说明,尽管此药在欧盟有十余年的使用历史,积累了丰富的真实世界证据,但是FDA专家鉴于双方管理的差异,担心真实世界证据的有效性而否决了药品上市申请。
此案例提醒所有试图采用真实世界证据(RWE)的团队,要充分评估自己提交的数据质量。
第三部分:真实世界证据的技术要求特点
根据NMPA在2020年1月发布的《真实世界证据支持药物研发与审评的指导原则(试行)》提到:真实世界数据的适用性主要通过数据相关性和可靠性进行评估。
1.相关性:评估真实世界数据是否与所关注的临床问题密切相关,其重要因素包括但不限于:(1)是否包含与临床结局相关的重要变量和信息,如药物暴露、患者人口学和临床特征、协变量、随访时间、结局变量等;(2)临床结局定义是否准确,相应的临床意义是否明确;(3)真实世界数据中的患者对于研究的目标人群是否具有代表性;(4)是否有足够的样本量以及随访时间以证明疗效并获取充分的潜在安全性事件。
2.可靠性:真实世界数据的可靠性主要从数据的完整性、准确性、透明性和质量保证方面进行评价。(1)完整性:真实世界数据无法避免数据缺失问题,包括变量的缺失和变量值的缺失。当数据缺失比例超过一定限度时,尤其涉及研究的关键变量时,例如影响研究结局的诸多重要预后协变量缺失或变量值缺失,会加大研究结论的不确定性,此时,需要慎重考虑该数据能否支持产生真实世界证据。(2)准确性:数据的准确性极为重要,通常需要参照较权威的数据来源进行识别或验证。数据元素和转化数据的算法均应保证其正确。数据的准确性还反映在数据的一致性和合理性上,一致性包括数据库内部的相关数据标准、格式和计算方法等必须一致;合理性包括变量数值的唯一性、合理的区间和分布、相关变量的预期依从关系以及时变型变量是否按预期改变等。(3)透明性:数据的来源、收集与治理的全过程应透明、清晰,并具有可溯源性,尤其是关键的暴露、协变量以及结局变量等应能追溯到源数据。数据的透明性还包括数据的可及性、数据库之间的信息共享和对患者隐私的保护方法的透明。(4)质量保证:真实世界数据的可靠性需考虑数据质量,质量保证的措施包括但不限于:数据收集是否有明确流程和合格人员;是否使用了共同定义框架,即数据字典;是否遵守采集关键数据点的共同时间框架;是否建立与收集真实世界数据有关的研究计划、协议和分析计划的时间安排;用于数据元素采集的技术方法是否充分,包括各种来源数据的集成、药物使用和实验室检查数据的记录、随访记录、与保险数据的链接以及数据安全等。
笔者根据自己的工作经验和认知,认为上面指导原则提到的真实世界证据(RWE)中需要引起中国药品企业高度关注的问题在最终一点-质量保证。因为国家局在2015年7月22日启动的临床试验数据核查所展示的现实情况是,中国过去由于对于临床试验监管不力,临床试验数据质量堪忧。
第四部分:真实世界证据在儿科用药领域应用展望
根据2020年5月发布的《真实世界证据支持儿童药物研发与审评的技术指导原则(征求意见稿)》,在儿科用药开发领域,真实世界证据可以在如下领域发挥作用:
(1)提供安全性证据:对于上市前没有开展过儿童临床研究或儿童临床研究数据较少的药物,还存在着由于生长发育与器官成熟度不同,药物在儿童中表现出的安全性特征可能不同于成人的问题,需要在上市后进行实际用药人群的安全性观察。
(2)支持用药方案优化:此类模式的目的是从儿科临床实际需要出发,细化目标治疗人群特征,在药物已有治疗学证据的基础上,设计进行优化用药方案的研究。研究结果用于扩充药物临床获益人群,完善医生处方及患者用药方案,支持药品说明书信息的更新。
(3)长期临床获益的评价:在RCT中使用替代终点(如生物标志物)进行疗效评估是部分儿童药物关键注册研究中允许采用的方法,尤其对于存在临床迫切用药需求且替代终点相对可靠的疾病领域。此类方法通常会伴随或附加以真实治疗环境中的临床疗效终点或终点事件为观察指标的长期临床获益研究,以完善证据链。
(4)提供剂量依据或验证剂量合理性:通过真实世界证据,包括回顾性的医疗数据分析和前瞻性的处方数据采集等,所提供的儿童剂量依据可以支持其说明书中相应内容的撰写。
总结
综上所述,虽然中国药政当局和制药行业刚刚开始尝试使用和理解真实世界证据,但是我们也欣喜的看到,很多行业先行者已经用自己的努力,为同仁展示了真实世界证据的价值和获益。希望在人类过去漫长时间积累的宝贵数据,可以再次被发掘和应用,产生更大的效益。
说明:本文不构成价值判断和投资建议。
参考文献
1- NMPA官网信息
2- CDE官网信息
3- FDA官网信息
4- 丁香园insight数据库
5-EMA《Reflection Paper on Expectations for Electronic Source Data and Data Transcribed to Electronic Data Collection Tools in Clinical Trials》
6- FDA《Submitting Documents Using Real-World Data and Real-World Evidence to FDA for Drugs and Biologics》
直播课程推荐




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57