鉴于制药行业内很多专家已经发表了对于这份文件的看法,笔者本不想置喙。但是有朋友热情相邀,我就在同时承受繁重的追剧和炒股压力的情况下,谈一点自己粗浅的看法。
关于委托生产的质量协议,NMPA这份文件不是第一份。美国FDA曾经在2016年11月份发布过一份指南《Contract Manufacturing Arrangements for Drugs: Quality Agreements》。当然了,除了FDA指南,还有APIC的质量协议指南,行业内都可以参考。
国内关于规范MAH和受托生产企业之间关系的协议,在2016年开始实施MAH制度试点时,上海局、浙江局、江苏局等地方药政机构都发布过类似协议指南。
下面,笔者就根据个人的粗浅理解,谈谈这份协议文件对于制药行业的影响。当然了,如果各位战友纵情山水,无意江湖,这份文件不会对你们产生什么影响。
一. 文件源起和指南文件定位问题
1.1 在2019年12月1日生效的《药品管理法》明确规定:国务院药品监督管理部门制定药品委托生产质量协议指南,指导、监督药品上市许可持有人和受托生产企业履行药品质量保证义务。因此说,这份质量协议指南的制定和实施,也算NMPA履行《药品管理法》的一个举措。
1.2 这份文件题目采用指南来命名,表明这份文件不是强制的,是给制药行业提供参考和借鉴的。但是官方指南毕竟是官方指南,文件内容体现了官方对相关问题的最新看法,行业要尽量遵守。对于这份指南没有涉及的其他问题,MAH和受托单位要遵循其他法规和自己的业务约定。
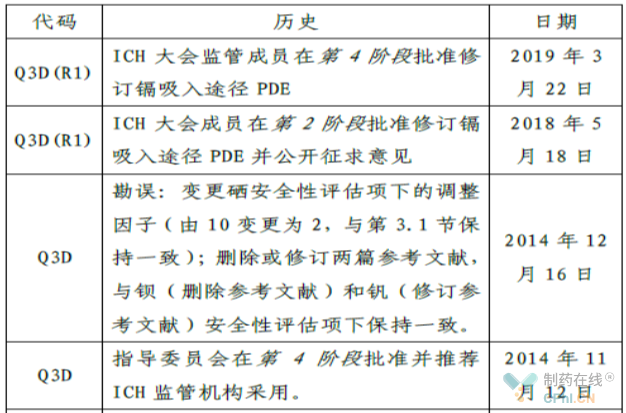
1.3 这份指南尽管经过2020年3月初的草案和后续反馈,但是在格式方面,还是沿袭了中国药政法规文件的不足。例如没有清晰编号系统,没有文件版本历史部分。
如果在中国药政法规文件上面可以出现类似下面的文件历史,以及类似EMA文件编号的编码体系,对于制药行业人员将是一大幸事。
二. 指南和后面模板的协调与部分内容遗漏
在2020年10月9日,NMPA发布的文件包括两份附件,分别是《药品委托生产质量协议指南(2020年版)》和《药品委托生产质量协议模板(2020年版)》。NMPA在组织专家撰写和发布这两份附件时,肯定做了协调工作,因为从指南和后续的模板看,具有一定的协调性。
2.1质量协议指南和模板协调部分
例如,不管是委托生产质量协议指南,还是后面的模板,都包括了药品生产的主要影响环节的规定:人员管理、厂房设施和设备管理、物料与产品管理、确认与验证管理、文件管理、生产管理、质量控制和质量保证、产品储存发运和召回、现场审核工作、合规性支持、监管部门监督检查、质量争议解决。
2.2质量协议指南和模板遗漏内容部分
我们尽管看到了两份文件大部分内容的协调一致;但是,我们也可以看到,不管是前面质量协议指南,还是后面的模板都存在一些不协调的内容。
---对于受托企业的人员和组织要求,质量协议模板要求偏少。只提到培训部分,没有提到专业经验、工作技能、体检等要求。
---共线评估部分尽管写出了主要内容,但是鉴于国际上涉及共线评估的新指南层出不穷,希望引起制药行业关注。国内共线评估指南也在起草过程中,MAH和受托单位都需要关注。
---确认和验证部分内容,缺乏对于仓储设施验证、运输验证的要求。
---模板中对于某些具体文件,给出的具体操作时间限制是不合适的。例如,模板提到"对于可能影响产品安全性、有效性和质量可控性的偏差和OOS,受托方应当在X日内书面通知持有人,并自偏差或者OOS发生之日起X日内完成调查,报持有人审核批准。"显而易见,对于偏差、变更、OOS、OOT、CAPA等事项,不应该在协议模板中规定具体完成时间,而应该在MAH和受托单位的相关规程中给出具体合理规定。毕竟,一个受托单位可能接受多个MAH的委托业务,如果每个MAH都给受托单位发出类似指令信息,而这些指令信息又是冲突的,受托单位的技术人员肯定会头疼欲裂。
---和上面情况类似,这份模板在产品质量回顾分析、投诉和不良反应处理等方面,都在模板正文中给出具体操作日期。显然,这不具有合理性和可操作性。笔者强烈建议,MAH和受托单位在具体规程中规定这些日期,并留出合理操作空间。
三. 偏差/OOS/OOT等问题处理中的权责分配问题
谈到药品生产和质量管理,就不能不谈到偏差、OOS/OOT等话题;这份指南也对类似问题进行了详细描述和规定。
综合质量协议指南和质量协议模板看,NMPA并强制要求MAH全程参与偏差和OOS/OOT的调查,而是强调MAH要对偏差和OOS/OOT的调查报告进行审核批准。这样的规定是合理的,因为偏差和OOS/OOT的调查不能脱离工作现场而进行,而这样的工作现场往往远离MAH。
但是,笔者在这里要郑重提醒MAH:一定在首次审计和后续审计时,对于偏差和OOS/OOT的调查能力进行充分评估,尤其是无效OOS的处理水平。因为这些能力和经验是依赖于技术团队长期辛苦工作积累的,而且对于MAH所委托产品具有关键影响。
四. 变更等问题处理中的权责分配问题
在2019年12月1日生效的《药品管理法》上面,破天荒的大谈变更管理要求,这在过去多个版本的《药品管理法》上是看不到痕迹的。随着《药品生产监督管理办法》和《药品注册管理办法》的发布实施,规范管理变更的步伐又近了一步。目前行业在翘首以盼的是配套的技术指导原则,希望快快定稿。
在质量协议指南上面,对于变更也是明确清晰规定的:持有人作为责任主体,要按照国家药品监督管理局的规定,全面评估、验证变更事项对药品安全性、有效性和质量可控性的影响。持有人和受托方应当按照药品管理法律法规规章和技术规范开展变更。任何一方进行可能影响药品质量的变更应当及时书面告知对方。质量协议应当规定双方均须建立变更控制程序,明确发生变更时的工作措施;应当规定委托生产产品相关变更的风险程度由持有人评估确定,受托方在变更实施前应当经持有人审核批准。
针对所委托的产品,如果发生涉及工艺或者处方的变更,肯定是MAH负责主体责任。但是针对受托单位的公用系统的变更,是否对所委托产品产生影响,也需要MAH进行关注和参与审核;例如压缩空气系统、工艺用水系统、HVAC系统和电子数据管控系统。
五. MAH要负责物料供应商的评估和批准工作
这份新委托生产质量协议指南的一个新变化是明确规定:质量协议应当规定由持有人进行物料供应商的选择、管理和审核,供应商应当符合国家药品监督管理局制定的生产质量管理规范以及关联审评审批有关要求。笔者猜测这样规定的原因应该有两个方面:担心受托单位为了节约审计成本而放松对供应商管理;另外,随着EHS成本持续提升,对于供应商管理难度加大,需要MAH亲自负责来完成。
MAH在完成供应商筛选、评估和审核批准后,需要把合格供应商目录移交给受托单位,纳入受托单位的采购体系。物料相关的其他工作,都可以由MAH委托给受托单位进行。
六. 产品全检和上市放行问题
质量协议指南明确规定:质量协议应当明确规定受托方负责成品的检验,必须保证完成成品的全检。检验完成后应当将检验报告书以复印件或者其他方式移交给持有人。但是这里的全检应该指的是:产品在被放行出厂之前,需要根据注册标准来完成全项检测,而不是要求受托单位具备全项检测能力。因为,后面提到:质量协议应当规定任何一方涉及原辅料、包装材料、中间产品和成品的委托检验都必须符合药品法律法规和GMP等要求,受托方将检验项目委托第三方检验时,应当经持有人审核批准。
关于产品上市放行工作,因为这是MAH的权力和责任的核心体现,因为质量协议指南明确规定:MAH负责委托生产药品的上市放行。
这里提醒MAH和受托单位,请思考如下问题:
---出厂放行和上市放行的SOP如何写,规定哪些前置条件?
---具体联系人怎么指定?联系邮箱是哪个?
---MAH如何获得产品信息?如何证明全面审核?如何确保上市放行的指令准确发给受托单位?
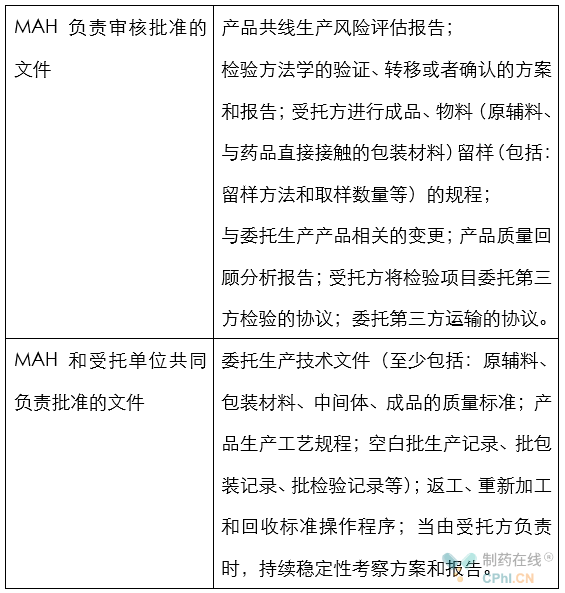
七.文件批准问题
这份质量协议指南,对于双方合作的文件进行了列举,并对相关文件的审核批准工作进行了细致规定;对于制药行业的工作,具有较明显指导意义。
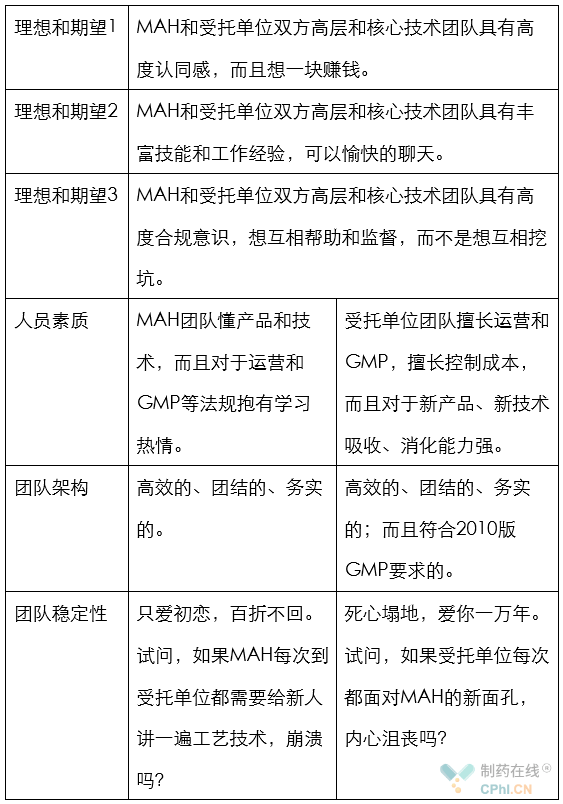
八.什么样的团队可以有效执行这份协议
当文章写到这个段落时,笔者觉得,不管是MAH的技术团队,还是受托单位的技术团队,都应该在仔细学习NMPA的质量协议指南后,和自己老板谈谈人生和理想。
NMPA不管制药行业从业者是否喝到了秋天的第一杯奶茶,而是在指南开始提到这样的要求:双方应当建立有效的沟通机制,在质量协议中确定技术质量直接联系人,及时就质量协议执行过程中遇到的问题进行沟通。
为了展示本人对有效沟通的理解,给出下面表格:
九.红线还是镣铐---未来无限苍茫
其实,写下最后这段小标题时,笔者心中也没有答案。但是既然各位制药同仁已经乐呵呵地开始MAH之路,本人还是想谨慎地、委婉地告知告知各位,如果你具有丰富工作经验,而且自己的产品热门,工艺稳定,并有幸寻找到志同道合的合作伙伴,这份质量协议指南和后面的模板就是你们开始幸福之旅的红线,对于双方都是利好。
反之,估计吵架和撕逼会不断出现。为了避免后续的无限痛苦,建议在受托单位筛选评估阶段和质量协议签署阶段,就做好吵架的准备。这样提前把该吵的都吵了,后续会更顺利一些。
上面就是笔者“不怀好意”的美好祝福,希望各位可以看懂。谢谢。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57