
随着2019年底新修订《药品管理法》对于药品上市后变更管理给出明确要求以来,国家药监局和下属CDE在持续努力,构建符合新修订《药品管理法》所要求的药品上市后变更管理体系。这个体系的一个关键文件,是2021年1月13日发布的《药品上市后变更管理办法(试行)》。
在这份专门为规范和厘清药品上市后变更所发布的规范文件中,国家局明确给各省局布置了相关任务和工作要求:
第一项任务:在收到国家局发文后,各省级药品监管部门应当落实辖区内药品上市后变更监管责任,细化工作要求,制定工作文件,明确工作时限,药品注册管理和生产监管应当加强配合,互为支撑,确保药品上市后变更监管工作平稳有序开展。
第二项任务:省级药品监管部门依职责负责辖区内持有人药品上市后生产监管事项变更的许可、登记和注册管理事项变更的备案、报告等管理工作;依法组织实施对药品上市后变更的监督管理。
随后,浙江省药监局一马当先,在国家局发文后第五天,就发布了全国 第一份省局关于药品上市后变更交流的文件。到目前为止,大约十多个省级药监局发布了类似文件。笔者不揣冒昧,搜集和整理最新信息,希望帮助全国药界同仁去了解2021年春天制药行业风云变幻的变更态势,帮助各位同仁去感受中国制药行业发展版图的战国基因。
第一部分:各省局发文目前最新统计情况
通过统计,截止到目前为止,全国各省级药监局中发布涉及药品上市后变更备案和变更交流文件的单位共13家,具体情况参见下表:
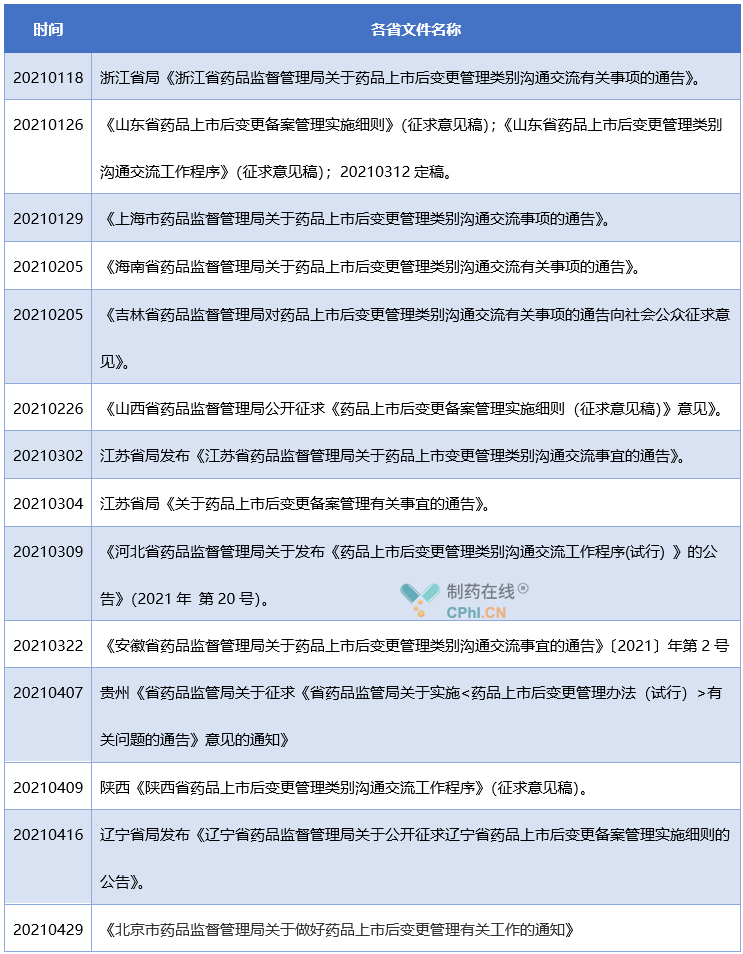
解析:全国共34个省级单位,如果不算港澳台,共31个省级单位。目前13个省级局发布配套文件,占比不到50%。
第二部分:各省局发文内容条款数量对比
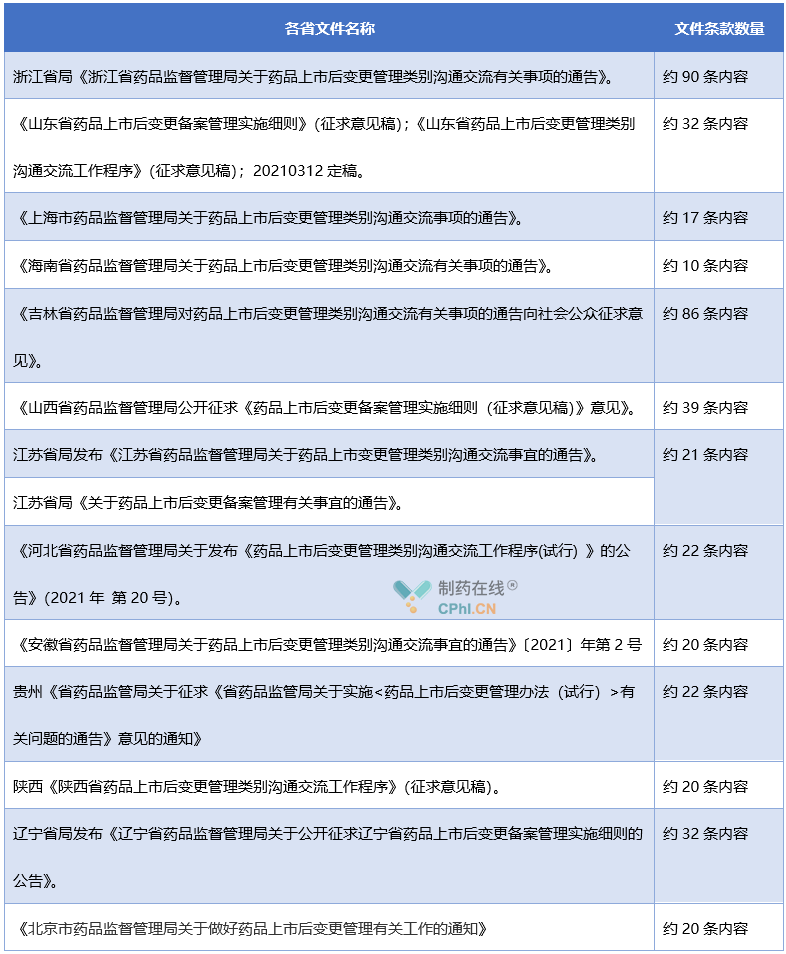
说明:
1-针对国家局要求的变更备案和变更交流文件,有的省局以两份文件形式来做出规定,有的省局采用一份文件统一规定。因此,这里统计时,为了便于对比,都视为一份文件来对待。
2-部分省局的文件附件内容很多,一律视为正文来统计。
解析:通过上面汇总和分析,可以看出来,在各省局发布的涉及药品上市后变更备案和交流文件中,在正文和附件中体现信息最多的是浙江省局和吉林省局。虽然山西省局的正文内容仅仅排在第三位,但是根据文件内容的要求看,山西省局对于制药企业提交沟通交流的文件质量要求,和浙江省局、吉林省局保持类似水平的高要求。
第三部分:各省局对于沟通交流文件质量要求对比
笔者通过阅读和对比,认为浙江省局、吉林省局和山西省局对于制药企业需提交支持变更沟通交流文件的质量要求最高。具体情况参见下表:

第四部分:各省局发文质量对比
必须坦率的说,下面的看法是笔者根据对比阅读得出的结论,可能不完善,仅供参考。如果药界同仁有更深刻认知,可以切磋。
通过对各省局发文的质量对比,笔者认为目前辽宁省局发文质量最高,针对行业难点和痛点不回避,给出了明确解答。北京市局发文质量也可以,但是相比较而言,还是比辽宁省局文件质量差一些。
辽宁省局发文特点参见下表:

在这里,针对制药行业目前正关注但是苦恼颇多的生产场地变更问题,我们看看辽宁省局的两条规定的要求和对比分析:

总结
从上面的内容和信息看,目前各省局积极发文配合国家局文件执行的情况,也和中国制药行业版图大体相匹配。目前已经正式发文或者进入落地实施阶段的省市局,多属于制药行业发达地区,或者属于制药行业传统优势地区。
如果说在建国初期,各行业布局和发展快慢更多地受国家资源分配和计划经济的影响;那么,现在制药行业发展则更多依赖于各省政策的灵活性和各地企业的积极拓展。
云聚云散,物换星移。希望各省局紧扣国家政策,学习先进,反思落后,在后续工作中奋勇争先,多为本省企业发展提供政策支持;而不是让本省企业由于缺乏合理政策导致在战国纷争的年代而落伍。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57