5月24日,美国FDA正式批准tapinarof(1%)乳膏上市,用于局部治疗成人斑块状银屑病。tapinarof中文名为本维莫德,于2019年5月在中国获批上市,商品名为欣比克,用于局部治疗成人轻至中度稳定性寻常型银屑病(以斑块型银屑病为主)。

(来源于公开资料)
历时20多年的本土“first-in-class”药
本维莫德是一种酪氨酸蛋白激酶抑制剂,可通过抑制T细胞酪氨酸蛋白激酶,干扰/阻断细胞因子和炎症介质的释放、T细胞迁移以及皮肤细胞的活化等发挥治疗作用。
本维莫德最初发现于一种天然微生物代谢产物中分离出来的非激素类小分子化合物,主要发明人是陈庚辉博士。后来权益几经转手,上市许可持有人为冠昊生物控股子公司广州中昊药业有限公司。
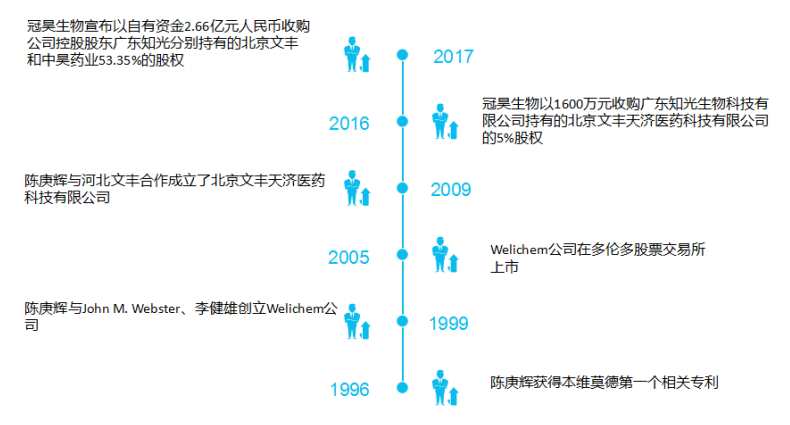
(根据公开资料整理)
2019年5月,本维莫德乳膏通过优先审评审批程序获批上市,用于用于局部治疗成人轻至中度稳定性寻常型银屑病。2020年12月28日,本维莫德乳膏正式纳入国家医保目录,2021年3月1日正式实施。
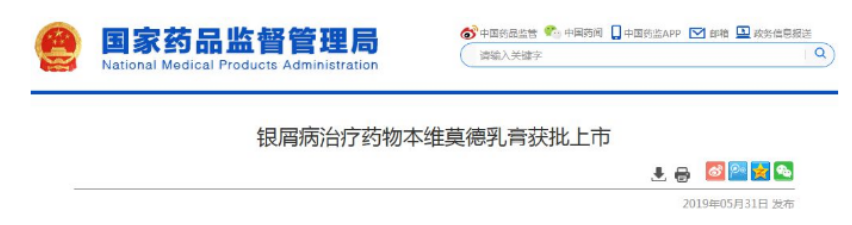
(来源于公开资料)
2019年、2020年、2021年销售额分别为1386.3万元、4075.8万元、2992.74万元。
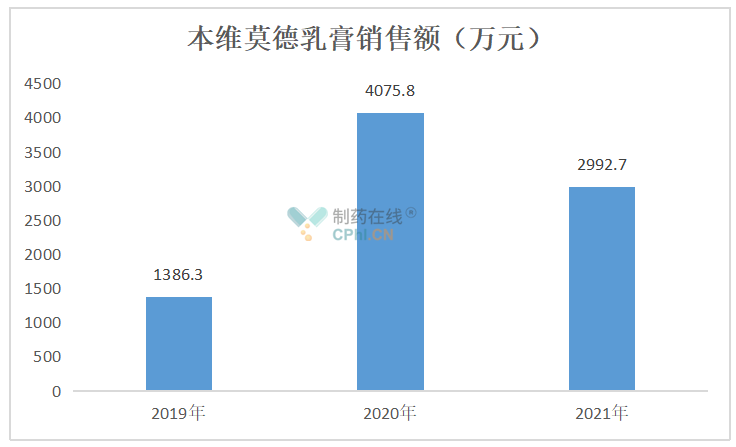
(数据来源于公开资料)
“闯关”FDA历程
从2021年8月申报上市到2022年5月正式获批,不到一年的时间。
2012年,由于良好的2期临床结果,GSK花费2.3亿美元购得本维莫德除大中华区市场以外的开发权;2018年,Dermavant Sciences成功以约3.3亿美元从GSK手上购买其大中华区以外的市场所有权。
2021年8月,Dermavant Sciences向FDA提交本维莫德的上市申请并获受理,适应症为斑块型银屑病。此次上市申请是基于3期临床试验PSOARING1和PSOARING2及开放标签的PSOARING3扩展研究。
在多中心、随机双盲、载体对照的PSOARING1和PSOARING2试验(n=1025)中,tapinarof均达到主要终点,大约五分之一的患者在治疗12周后,达到银屑病面积和严重程度指数改善90%以上(PASI90)的标准。
PSOARING3(参加过PSOARING1和PSOARING2的患者继续接受为期40周的tapinarof治疗)中期结果表明,57.3%具有皮肤症状的受试者在接受治疗后达到医生整体评估(PGA)评分为0(皮肤症状完全清除),或1(皮肤症状几乎完全清除)的标准。此外,患者停药后治疗效果能够维持4个月。
还有哪些药获批
理性地看,由于冠昊生物并不拥有本维莫德海外权益,因此FDA获批对国内影响不大,但是对于国内创新药的意义非凡。
要知道,今年已经有4个国产药冲击FDA失败,分别是万春医药的普那布林、信达生物的信迪利单抗、和黄医药的索凡替尼以及君实生物的特瑞普利单抗。这4个药有的需要补充临床试验,有的需要变更质控流程。
与此同时,还有3个药在等待FDA的审评结果,分别是百济神州的替雷利珠单抗、亿帆医药的贝格司亭以及百济神州的泽布替尼新增适应症。
值得一提的是,2022年5月,恒瑞的PD-1单抗卡瑞利珠注射液联合阿帕替尼一线治疗晚期肝细胞癌的临床试验达到主要临床终点,预计今年也将向FDA提交上市申请。
国产创新药FDA申报详情
|
公司 |
药品 |
靶点 |
申报适应症 |
申报临床试验 |
临床试验 地点 |
对照组药物 |
临床试验终点 |
目前 状态 |
FDA结论日期 |
|
百济神州 |
泽布替尼 |
BTK |
既往接受过至少一项疗法的成年套细胞淋巴瘤患者 |
BGB-3111-206 |
中国 |
单臂临床 |
ORR、PFS |
已获批 |
2019/11 |
|
用于成人华氏巨球蛋白血症(WM)患者 |
ASPEN |
国际多中心、欧美澳 |
伊布替尼 |
VGPR |
已获批 |
2021/8/31 |
|||
|
用于既往至少接受过一种抗CD20方案治疗的复发或难治性边缘区淋巴瘤(R/RMZL)成人患者 |
MAGNOLIA |
国际多中心、欧美澳中 |
单臂临床 |
ORR |
已获批 |
2021/9/15 |
|||
|
BGB-3111-AU-003 |
国际多中心、欧美亚太 |
单臂临床 |
ORR |
||||||
|
用于成人慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者 |
ALPINE |
国际多中心、欧美亚太 |
伊布替尼 |
ORR |
? |
2022/10/22 |
|||
|
SEQUOIA |
国家多中心、欧美亚太 |
苯达莫司汀+利妥昔单抗 |
PFS、ORR、OS |
||||||
|
替雷利珠单抗 |
PD-1 |
二线治疗晚期或转移性食管鳞状细胞癌(ESCC) |
RATIONALE302 |
国际多中心、欧美亚太 |
化疗 |
OS |
? |
2022/7/12 |
|
|
万春医药 |
普那布林 |
G-CSF |
联合长效G-CSF用于预防化疗引起的中性粒细胞减少症 |
PROTECTIVE-2 |
中国、乌克兰 |
培非格司亭 |
中性粒细胞减少时间 |
未获批,需要第二个对照注册临床研究 |
2020/12/1 |
|
传奇生物 |
Cita-Cel |
BCMA |
成人复发和/或难治性多发性骨髓瘤(r/rMM) |
CARTITIDE-1 |
国际多中心、欧美亚太 |
安慰剂 |
ORR |
已获批 |
2022/2/28 |
|
信达生物 |
信迪利单抗 |
PD-1 |
信迪利单抗注射液联合培美曲塞和铂类用于非鳞状非小细胞肺癌一线治疗 |
ORIENT-11 |
中国 |
安慰剂 |
PFS |
未获批,需补充临床试验 |
2022/3/24 |
|
和黄医药 |
索凡替尼 |
多靶点TKI |
胰 腺和非胰 腺神经内分泌瘤(NET) |
SANET-p |
中国 |
安慰剂 |
PFS |
未获批,需要纳入更多美国患者人群的国际多中心临床试验 |
2022/5/2 |
|
SANET-ep |
中国 |
安慰剂 |
PFS |
||||||
|
NCT02549937 |
美国 |
桥接试验 |
/ |
||||||
|
君实生物 |
特瑞普利单抗 |
PD-1 |
特瑞普利单抗联合化疗一线治疗鼻咽癌 |
JUPITER-02 |
亚太 |
安慰剂 |
PFS |
未获批,需变更质控流程,并完成现场核查 |
2022/5/2 |
|
特瑞普利单抗单药用于鼻咽癌含铂治疗后的二线及以上治疗 |
POLARIS-02 |
中国 |
单臂临床 |
ORR、PFS、OS |
|||||
|
亿帆医药 |
贝格司亭 |
G-CSF |
用于治疗化疗致中性粒细胞减少症(CIN) |
GC-627-05 |
美国 |
培非格司亭 |
中性粒细胞减少时间 |
2022年3月30日FDA通知,因旅行限制,FDA将推进其上市申请批复,直到其现场检查完成 |
|
|
GC-627-04 |
美国 |
安慰剂 |
中性粒细胞减少时间 |
(根据公开资料整理,若有不全处欢迎补充,国产药已海外授权的不在本表统计范围内)
FDA提出更高的临床数据要求
目前,国际人用药品技术要求协调理事会(ICH)对药品上市有效性数据的要求,已经从过去的序贯性地在不同地区做桥接试验,发展成了主张进行国际多中心临床试验,并在国际多中心临床试验中考虑不同地区的差异。比如,大部分获FDA批注的药都是基于国际多中心临床试验。
根据ICH和美国监管规定的要求,特定情况下可以接受纯外国数据,在以下3个要求都满足的情况下,可以仅基于外国人的临床数据给予批准上市。
(1)适用性:临床试验设计和数据适用于美国人群和美国临床实践;
(2)研究由具有公认能力的临床研究者进行;
(3)临床数据具有可靠性,FDA认为不需要核查或通过FDA现场核查或通过FDA其他方式的核查。
但特殊情况下,FDA表示可以考虑灵活的监管政策。几种特殊情况,包括针对为满足的临床需求的药物、针对罕见病的药物以及新的药物种类。
基于上述情况,百济神州的替雷利珠单抗、亿帆医药的贝格司亭以及百济神州的泽布替尼新增适应症能否顺利获批,笔者将持续关注。
参考资料:中国医药研发创新专题(2021):在探索中坚持前行



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57