7月19日,诺华「奥马珠单抗注射液」新适应症(受理号:JXSS2200025)申报上市。
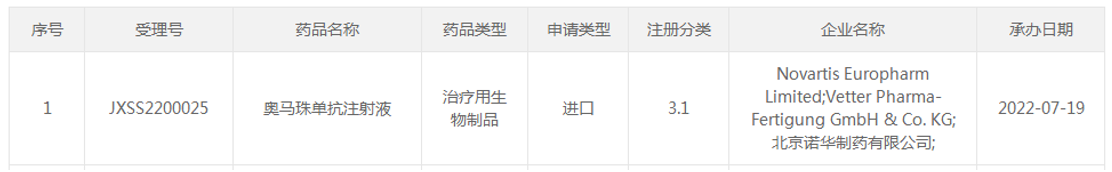
(资料来源:CDE官网)
全球首 个治疗哮喘的靶向药物
奥马珠单抗(Omalizumab、商品名:Xolair/茁乐)是诺华和罗氏旗下基因泰克合作开发的一款抗IgE人源化单克隆抗体,通过特异性结合血清内游离的IgE、阻断其致炎通路发挥作用。
奥马珠单抗于2002年被澳大利亚首次批准上市,至今已在全球超过90个国家批准上市,且获批多个适应症,如中重度持续性过敏性哮喘、慢性特发性荨麻疹和慢性鼻-鼻窦炎伴鼻息肉。
2017年8月,奥马珠单抗首 个适应症(受理号:JXSS1400005)在中国批准上市,用于治疗12岁以上经吸入激素合并长效β2-肾上腺素受体激动剂治疗控制不佳的中重度过敏性哮喘患者,并于2019年进入国家医保。
2022年4月,奥马珠单抗第2个适应症(受理号:JXSS2100003)在国内获批上市,用于治疗采用H1抗组胺药治疗后仍有症状的成人和青少年(12岁及以上)慢性自发性荨麻疹患者,成为目前国内唯一获批用于治疗慢性自发性荨麻疹的生物制剂。
此外,奥马珠单抗在新的医保谈判初步审查名单中,届时将按照协议重新确定支付标准。
奥马珠单抗上市后全球销售额保持稳步增长,2021年全球销售额为34.33亿美元,同比增长6.71%。
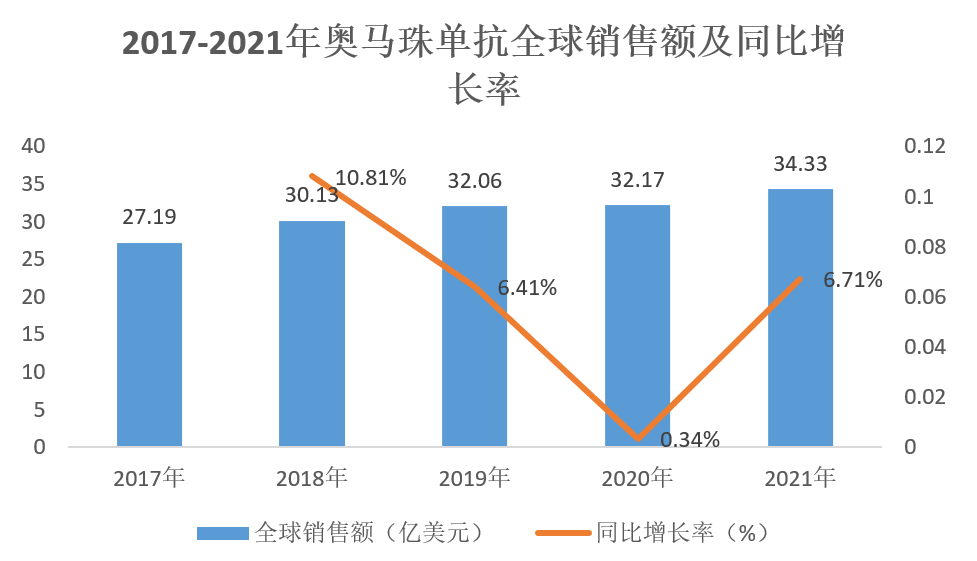
(数据来源:诺华、罗氏年报)
有两个适应症已申报上市
目前,除了已经获批的两个适应症,奥马珠单抗还有两个适应症已申报上市。
2021年4月,奥马珠单抗第3个适应症(受理号:JXSS2101002/3)申报上市,用于经吸入型糖皮质激素和长效吸入型β2-肾上腺素受体激动剂治疗后,仍不能有效控制症状的中至重度持续性过敏性哮喘。适用人群为成人、青少年(12岁及以上)和儿童(6至<12岁)患者。
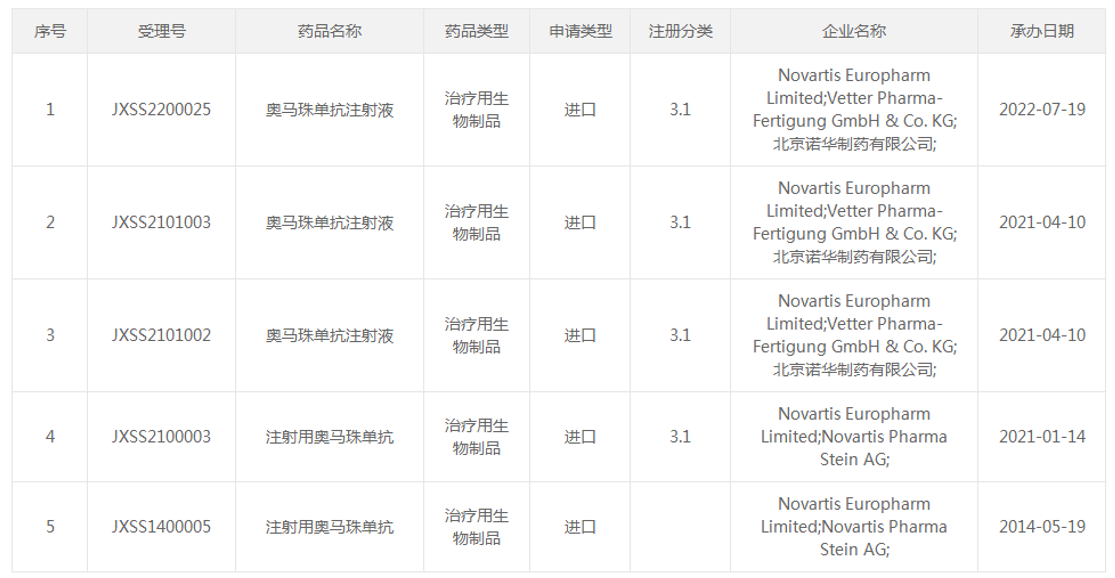
(资料来源:CDE官网)
笔者查询 ClinicalTrials官网,奥马珠单抗在中国开展的3期临床试验有5项,其中3项已完成,对于此次申报上市的适应症,笔者推测可能为难治性慢性鼻窦炎。
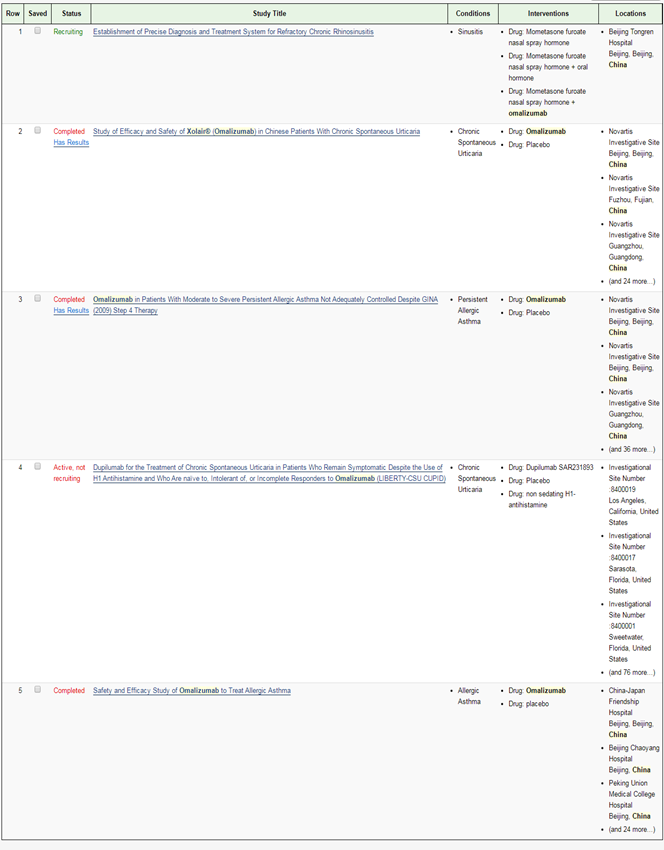
(资料来源: ClinicalTrials)
2020年8月,欧盟委员会(EC)批准奥马珠单抗新适应症,作为鼻内皮质类固醇(INC)的附加(add-on)疗法,用于治疗采用INC不能充分控制病情的严重慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)成人患者(≥18岁)。III期研究表明,奥马珠单抗缩小了鼻息肉大小(采用鼻息肉评分[NPS]定义)、改善了CRSwNP患者的症状和生活质量。
首 个生物类似药申报上市
奥马珠单抗的化合物专利于2018年到期。2021年10月,泰州迈博药业的注射用CMAB007在国内递交上市申请并获受理。CMAB007是国内首 个申报上市的奥马珠单抗生物类似药,拟开发用于:治疗经过中/高剂量吸入型皮质激素加长效β肾上腺素受体激动剂治疗之后,仍然得不到充分控制的哮喘病人。

(资料来源:CDE官网)
石药集团、上海百迈博制药、海正药业、远大医药健康也在开发该产品的生物类似药。目前处于临床阶段。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57