9月19日,NMPA官网发布批件,南京百鑫愉医药2.2类新药「依达拉奉舌下片」获批上市,适应症为抑制肌萎缩侧索硬化(ALS)所致功能障碍的进展。南京百鑫愉医药成为首家获得依达拉奉舌下片上市批件的药企。
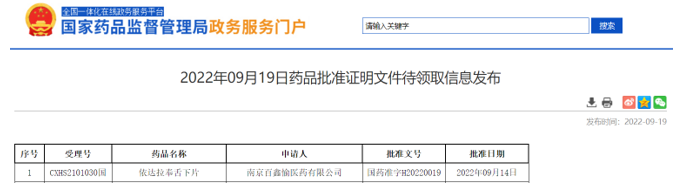
(资料来源:NMPA官网)
首 个获批的2.2类新药-依达拉奉舌下片
依达拉奉是一种自由基清除剂,用于治疗缺血性脑卒中等心脑血管疾病。目前,国内已上市的依达拉奉制剂只有注射剂。
依达拉奉舌下片属于2.2类改良新药,可以通过舌下黏膜直接被吸收入血循环,发挥疗效。相较于注射液,舌下制剂更加安全、可及、便捷,适用于患者及时给药和恢复期的院外给药。
药物临床试验登记与信息公示平台显示,南京百鑫愉医药在国内开展了三项关于依达拉奉舌下片的临床研究,适应症分别为肌萎缩侧索硬化症(ALS)、脑卒中以及用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍。
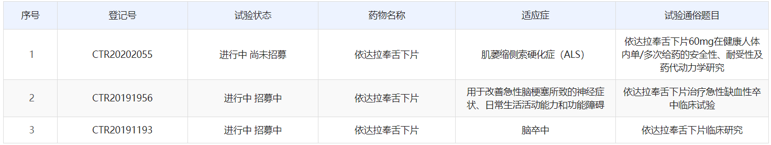
(资料来源:药物临床试验登记与信息公示平台)
2021年5月,南京百鑫愉医药提交依达拉奉舌下片的上市申请,2021年7月该上市申请获CDE受理,同时被纳入优先审评,适应症为抑制肌萎缩侧索硬化(ALS)所致功能障碍的进展。
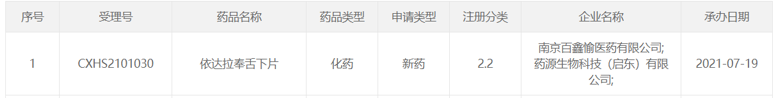
(资料来源:CDE官网)

(资料来源:CDE官网)
南京百鑫愉医药成为首家获得依达拉奉舌下片上市批件的药企。
先声药业的依达拉奉舌下片进入Ⅲ期
笔者查询了CDE官网,目前只有南京百鑫愉医药提交了依达拉奉舌下片的上市申请并获受理。
目前,虽然申报上市只有南京百鑫愉医药一家,但是先声药业开发的Y-2舌下片(即依达拉奉舌下片,又称先必新舌下片)在国内治疗急性缺血性卒中的多中心、随机、双盲、平行、安慰剂对照Ⅲ临床试验在2022年5月完成规划中的914例的全部患者入组,预期将于2022年完成中期分析。此外,Y-2舌下片在美国的临床试验已经进入临床Ⅰ期。
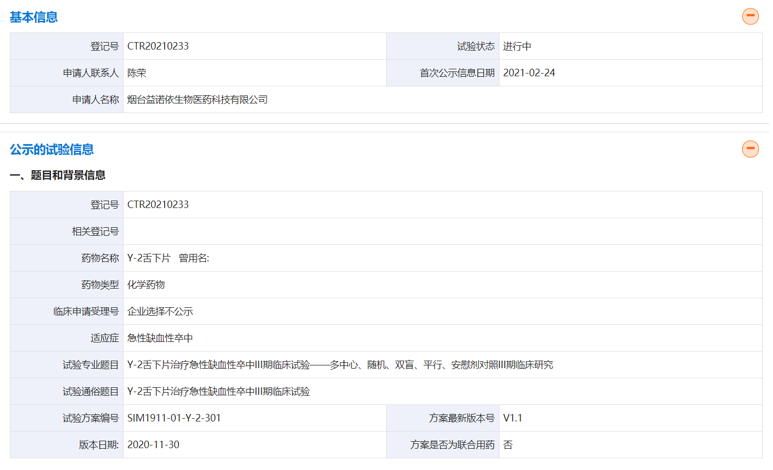
(资料来源:药物临床试验登记与信息公示平台)
关于肌萎缩侧索硬化症(ALS)的治疗
肌萎缩侧索硬化症(ALS)也叫运动神经元疾病,是一种罕见的累及上运动神经元(大脑、脑干、脊髓),又影响到下运动神经元(颅神经核、脊髓前角细胞)的神经退行性疾病,在中国俗称"渐冻人症",可导致肌无力、残疾和最终死亡,中位生存期为3-5年。
ALS有90%至95%的发病原因不明,约5%至10%遗传自父母。大约有一半的病例是由两个特定基因引起的。其导致控制随意肌的神经元死亡。该病的诊断基于个人症状和体征测试,以排除其他致病的可能。
目前,ALS患者的主要治疗手段是及时干预以控制症状。没有药物可为ALS患者带来实质性的临床获益。利鲁唑可能提供有限的生存期改善(2-3个月),依达拉奉可能在一定程度上减缓功能的下降。
2018年5月,国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,肌萎缩侧索硬化在列;2019年5月,CDE发布第二批临床急需境外新药名单,田边三菱制药的依达拉奉氯化钠注射液以罕见病用药被纳入,适应症为肌萎缩侧索硬化。
目前国内已上市的多款依达拉奉注射剂,主要适应症为用于改善急性脑梗塞所致的神经症状、日常生活活动能力和功能障碍,大部分都不能用于ALS的治疗。
2020年4月,江苏正大丰海制药的3类仿制药-依达拉奉氯化钠注射液用于治疗ALS新适应症获批,成为国内唯一同时拥有脑梗塞和ALS两大适应症的依达拉奉制剂。
50亿蓝海市场
以脑卒中这个适应症来推测依达拉奉舌下片的市场规模。
根据先声药业招股书引用的弗若斯特沙利文的数据,我国现存脑卒中患者数将由2020年的1660万人增长到2024年的1980万人,假设此后每年增速为4%;2020年每年新发患者约340万人,假设此后每年增速为2%,假设其中缺血性脑卒中的比例为70%。有业内人士根据上述数据预计,先声药业的先必新注射液销售峰值有望达46亿元,先必新舌下片销售峰值有望达到24亿元。
鉴于国内治疗脑卒中以及ALS的药物并不多,因此,国内首 个2.2类新药依达拉奉舌下片能否撬动约50亿蓝海市场,我们拭目以待。
参考资料:
1、方正证券-先声药业-2096.HK-差异化产品布局+卓越商业化能力,创新转型步入收获期
2、50亿市场即将迎新变局?改良型新药「依达拉奉舌下片」报上市拟纳入优先审评



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57