美国FDA为了监管药品,除了发布大量法规,还为了弥补法规的不足,颁布了很多配套的指南和工作手册,这些文件共同构成了FDA监管药品的体系。为了帮助大家掌握和理解这些指南,特撰写此文,以供行业同仁参考。
第一部分:FDA工业指南
◆FDA下属的CDER发布了很多技术指南,也和其他技术中心,联合发布了很多指南。具体网址参见下面:
https://www.fda.gov/drugs/guidance-compliance-regulatory-information/guidances-drugs
鉴于指南梳理很大,因此分为很多技术专题;参见下面截图:

检索地址参见下面截图:
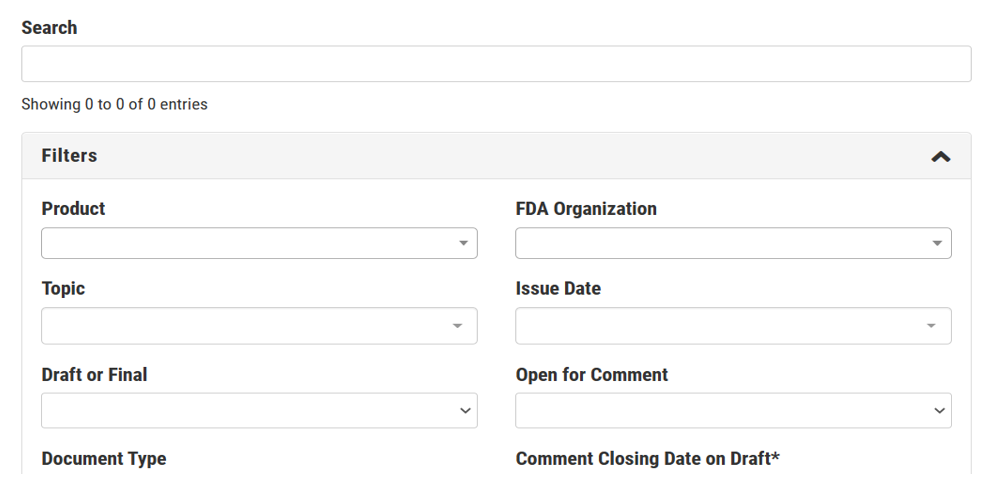
在上面各个检索栏目输入相关信息,可以检索到读者期望的指南。
◆FDA下属的CBER发布了很多针对生物制品监管的指南,具体网址参见:
https://www.fda.gov/vaccines-blood-biologics/guidance-compliance-regulatory-information-biologics
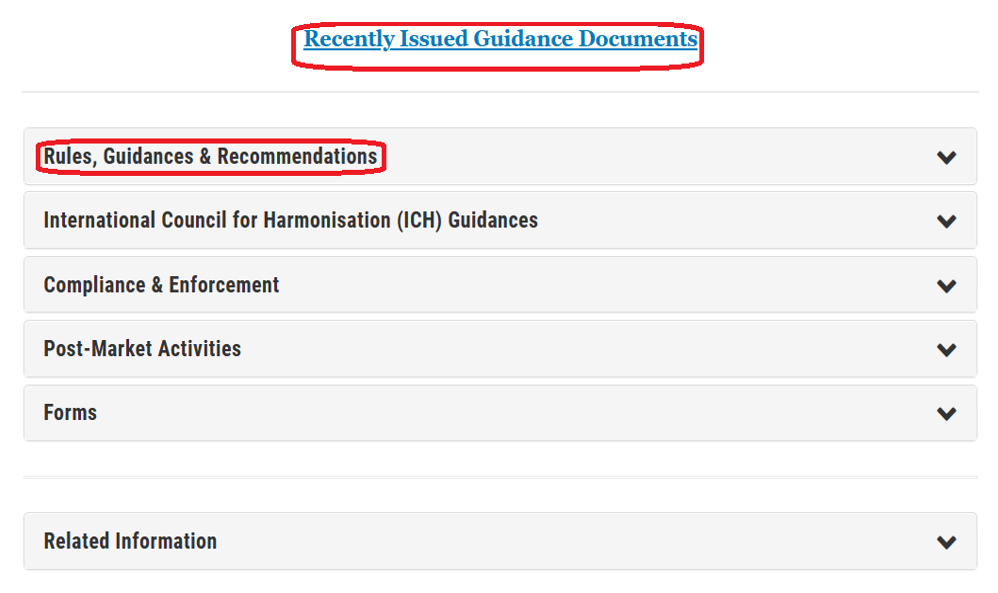
读者点击上面链接,可以快速检索到CBER最近发布的指南,以及各个分类的指南文件。
第二部分:FDA cGMP问答
美国针对药品的cGMP是21CFR210&211。鉴于CFR法规描述很原则,为了协助制药行业理解美国GMP的细致要求,FDA发布了二级指南cGMP问答。具体网址参见下面链接:

从上面截图可以看出,这部分二级指南分为很多专题,例如厂房设施、实验室控制等专题。
点击"Records and Reports",可以进入这部分专题:

上面这些技术问答反映了FDA对此问题的最新技术观点。
第三部分:CPM手册
Compliance Program Manual,是FDA为了监管制药行业发布的一系列合规计划手册。参见下面网址:
https://www.fda.gov/drugs/guidance-compliance-regulatory-information/drug-compliance-programs
具体截图参见下面:
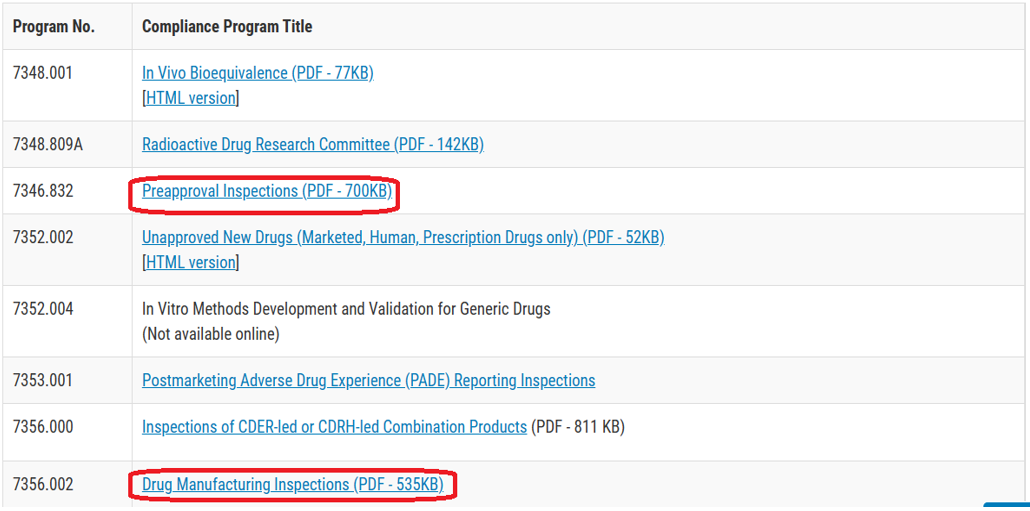
从上面截图可以看出,制药行业广泛关注的PAI就是依据CPM7346.832这份手册提出的。而下面那份手册7356.002则提出了著名的六大体系检查法。
第四部分:Manual of Policies & Procedures
为了指导FDA员工完成各类技术工作,FDA组织起草了大量的政策和规程手册(MAPP)

这是部分内容截图,可以看出文件编号、发布办公室、文件题目、归类和签发日期。
第五部分:Inspection Technical Guides
为了培养检查人员的技术能力和协调标准,FDA起草了很多检查技术指南,以对自己员工提供技术支持。参见下面网页:
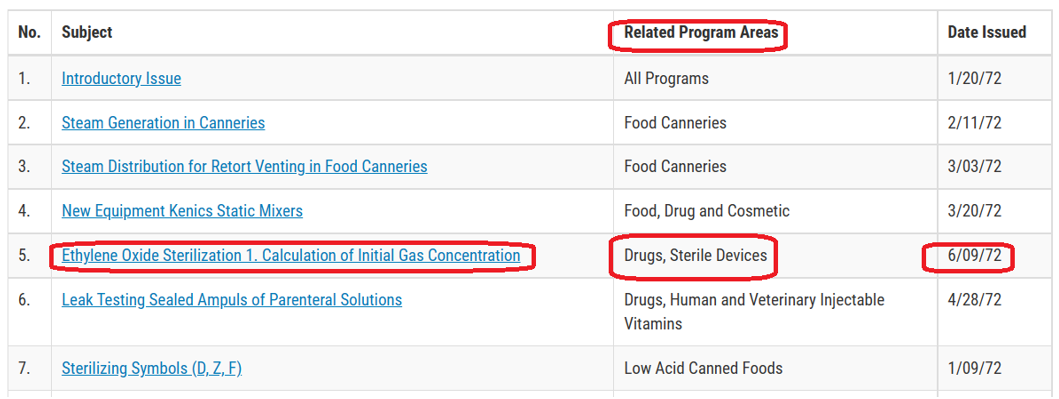
提醒:这些指南虽然还在FDA官网可以查询到,但是鉴于发布年代久远,因此用户使用时,要结合最新技术要求综合考虑。
第六部分:Biotechnology Inspection Guide
和上面第五部分提到的药品检查指南类似,FDA为了规范对生物制品的检查工作,也起草了很多针对生物制品的检查指南,参见下面网址:

总结
综上所述,为了服务法规立法目的和市场监管,FDA起草了大量技术指南,也会行业发展提供了支持。然而,这些工作并不都是完 美的,例如部分指南过于陈旧,修订不及时等情况。即使这样,对于FDA工业指南的持续关注,还是对于药品研发、注册和审评具有显著意义的。岁末年首,笔者有一个猜测:FDA在2023年对中国制药企业检查力度会明显增加,需要引起大家的注意。
说明:本文不构成任何价值判断和投资建议。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57