近日,福沃药业宣布,其自主研发的第三代口服选择性雌激素受体降解剂(SERD)FWD1802用于ER+/HER2-不可切除的局部晚期或转移性乳腺癌患者的1期临床研究成功完成第一例受试者给药。FWD1802已在美国和中国获批开展临床试验。
FWD1802是福沃药业开发的第三代口服SERD,拟用于治疗ER+/HER2-乳腺癌。根据福沃药业新闻稿介绍,该候选药兼具ER降解和拮抗的双重作用,具有比同类药物更强的体内、体外药效,并且对于上一代用药后产生的ER突变同样有效。这使得FWD1802不仅有望成为上一代SERD的后线治疗,更有潜力替代上一代SERD成为新的标准治疗。同时,FWD1802还展示出了良好的体内生物利用度,在临床上患者可以采用更加便捷的口服用药。
据悉,本次完成首例受试者给药的1期临床试验是FWD1802的首次人体临床研究。该研究是一项单药治疗和与哌柏西利联合治疗的临床试验,包括开放剂量递增和剂量扩展两部分,旨在评估FWD1802在ER+/HER2-不可切除的局部晚期或转移性乳腺癌受试者中口服给药的安全性、耐受性、药代动力学、药效动力学和初步的抗肿瘤活性。
60亿级赛道!SERD药物市场潜力巨大
乳腺癌是全球女性中最常见的恶性肿瘤之一,患者人数逐年增加。根据预测,到2030年全球乳腺癌患者将达到825万例,中国将达到168.8万例。乳腺癌药物市场规模也在不断增长,据弗若斯特沙利文预测,全球乳腺癌药物市场预计在2024年将增长至434亿美元,2030年达到699亿美元。中国市场预计在2024年将增长至739亿元,2030年增长至1,223亿元。
据临床统计,约60%~75%的乳腺癌患者其ER表达呈阳性。针对ER+乳腺癌,常用的治疗方法包括雌激素受体调节剂、芳香酶抑制剂、卵巢功能抑制剂和CDK4/6抑制剂等。其中,SERD药物可以更有效地阻断ER受体信号通路,诱导其降解。随着乳腺癌发病率的增加,SERD药物市场规模也在扩大。全球SERD靶向药市场规模从2016年的8亿美元下降到2020 年的6亿美元。随着未来口服SERD靶向药逐渐上市,弗若斯特沙利文预测未来SERD靶向药市场规模会开始扩大,预计在2025年达到 24亿美元,并在2030年达到66亿美元。
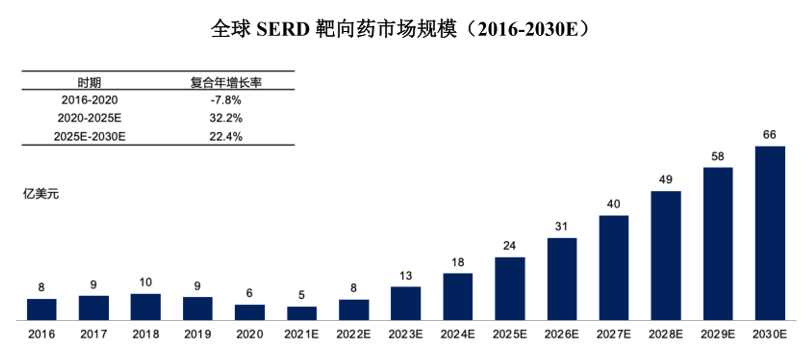
全球SERD市场规模预测
图片来源:弗若斯特沙利文
氟维司群作为全球首 款获批上市的SERD靶向药,曾一度独霸SERD靶点长达二十年,为阿斯利康带来了丰厚的利润,2018年达到销售峰值10.28亿美元,尽管此后遭到仿制药上市导致销售额下滑,但仍能在2021年贡献超过4亿美金的销售额。
2010年,氟维司群在中国获批,可作为单药或与CDK4/6抑制剂或mTOR抑制剂联用作为晚期乳腺癌的内分泌治疗。2017年,氟维司群降价43%进入医保,年治疗费用约5.1万元。
然而,由于氟维司群只能肌肉注射给药,生物利用度低,可及性欠佳,且对ESR1突变患者的疗效并不好,因此市场亟需新一代的口服SERD,拥有更高的生物利用度、更强的受体降解能力,以替代氟维司群。
口服SERD药物:竞争才刚刚开始
去年以来,赛诺菲和罗氏接连宣布其SERD口服药Ⅱ期临床研究均没能达到无进展生存期这一主要终点,给SERD口服药研发蒙上了阴霾,也让SERD药物市场前景变得扑朔迷离。
今年1月27日,意大利药企美纳里尼的Elacestrant(艾拉司群)率先突围,最终摘得首 款SERD口服药的桂冠,给后续正在挣扎跃栏的诸多SERD口服药玩家注入了一针强心剂。此番FDA的批准是基于III期EMERALD研究结果,数据显示:在总人群和ESR1突变的乳腺癌患者中,Elacestrant的中位PFS分别为2.8个月和3.8个月,而氟维司群组均为1.9个月;Elacestrant的6个月PFS率为34.3%和40.8%,而氟维司群组为20.6%和19.3%;12个月PFS率对比情况则为22.3%比9.5%、26.8%比8.3%。此外,与标准治疗相比,Elacestrant在整体队列中显著降低了30%的进展或死亡风险;在ESR1突变的患者中降低了45%。
虽然Elacestrant达到了临床终点,抢占了先发优势,但这款药物并不是十分完 美。从临床结果看,在总人群中仅仅给患者带来了不到一个月的生存期延长,临床优势并不明显;从药代动力学看,Elacestrant生物利用度仅为10%,几乎不透过血脑屏障(ER+乳腺癌的脑转移率约10~15%),后来者将有很大机会实现"弯道超车"。
其中,阿斯利康的Camizestrant备受关注。在SERENA-2的II期研究中,阿斯利康的Camizestrant达到主要终点。在总人群中,与氟维司群相比,两种剂量(75mg和150mg)Camizestrant均可使PFS产生具有统计学和临床意义的改善,分别将疾病进展或死亡的风险降低42%及33%,且中位PFS达到7.2个月及7.7个月(氟维司群组:3.7个月)。
此外,礼来的Imlunestrant正在开展 EMBER-3、 EMBER-4 两项大型全球 III 期临床,并于2022年3月在国内首次申报临床。MBER-3 研究旨在比较 Imlunestrant 和研究者选择的内分泌疗法、以及 Imlunestrant 联合阿贝西利相较于 Imlunestrant 单药治疗 ER+/HER2- 局部晚期或转移性乳腺癌患者的 PFS 是否改善。CDK4/6 抑制剂与 SERD 的联合疗法近年来正在火热开发中,而礼来正拥有着市场潜力无限的阿贝西利,与阿贝西利的联用将为礼来未来攻占乳腺癌领域提供更多机会。而另一项大型全球 III 期临床 EMBER-4 研究,旨在评估 Imlunestrant 辅助治疗对比标准辅助内分泌疗法,在既往接受 2 至 5 年辅助内分泌治疗的 ER+、HER2- 早期乳腺癌且具有较高复发风险的患者中的疗效和安全性。
国内方面,益方生物的SERD口服药D-0502是研发进度最快的药物之一。目前正在中国和美国同步开展国际多中心临床试验,根据CDE官网,D-0502单药作为二线疗法已经获得III期临床的批准,预计将于2024年申报NDA,同时益方生物还在开展联用辉瑞CDK4/6抑制剂哌柏西利的临床试验。除福沃药业外,国内的恒瑞医药、先声药业、冰洲石生物、安道药业等也有布局SERD管线,目前都还处于临床早期阶段。
SERD口服药将会成为乳腺癌治疗领域一颗冉冉升起的新星,而下一款SERD口服药将从上述这些竞争者中诞生。如果顺利,近两年业界将迎来SERD口服药的爆发期。
参考来源
1. Elacestrant (oral selective estrogen receptor degrader) Versus Standard Endocrine Therapy for Estrogen Receptor-Positive, Human Epidermal Growth Factor Receptor 2-Negative Advanced Breast Cancer: Results From the Randomized Phase III EMERALD Trial. J Clin Oncol. 2022 Oct 1;40(28):3246-3256.
2. FDA approves elacestrant for ER-positive, HER2-negative, ESR1-mutated advanced or metastatic breast cancer;FDA官网
3. Ferraro E,et al. Cancer Treat Rev. 2022 Jun 27;109:102432.
4. Maglakelidze M, et al. 2021 ASCO Abstract 1063.
5. Bidard F-C,et al. 2021 SABCS Abstract GS3-05.、
6. 各企业官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57