2024年3月10日,艾伯维(AbbVie)宣布其利生奇珠单抗注射液(Risankizumab)及其皮下注射剂型获中国国家药品监督管理局(NMPA)批准,用于治疗对传统治疗或生物制剂应答不足、失应答或不耐受的中重度活动性克罗恩病成年患者;这是继2023年该药在中国获批银屑病适应症后,艾伯维在免疫领域的重要布局。
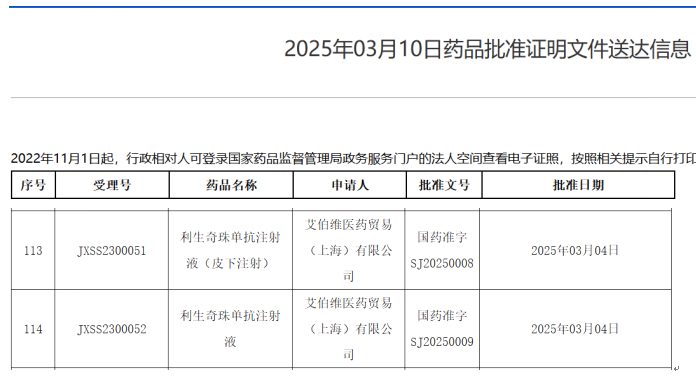
图源:NMPA官网
克罗恩病(Crohn's Disease, CD)是一种慢性、复发性炎症性肠病(IBD),其全球发病率逐年上升。在中国,随着生活方式和饮食习惯的改变,克罗恩病患者数量近十年增长显著,据《中国炎症性肠病诊疗现状白皮书》统计,患者总数已超过50万,其中约30%处于中重度活动期。传统治疗手段(如糖皮质激素、免疫抑制剂)及早期生物制剂(如抗TNF-α药物)存在应答率低、耐药性及安全性问题,患者亟需更高效、安全的治疗方案。
靶向IL-23:精准调控免疫通路
利生奇珠单抗是一种人源化IgG1单克隆抗体,选择性靶向IL-23的p19亚基;IL-23是Th17细胞分化和炎症因子(如IL-17、IL-22)释放的关键调控因子,在克罗恩病等自身免疫疾病的病理过程中起核心作用。与第一代IL-12/23抑制剂(如乌司奴单抗)相比,利生奇珠单抗仅抑制IL-23,避免了阻断IL-12可能导致的感染风险增加,理论上安全性更优。
关键临床试验研究:皮下注射或成“杀手锏”
利生奇珠单抗的获批基于两项全球多中心III期临床试验(ADVANCE和MOTIVATE)及维持期研究FORTIFY的中国亚组数据,全面验证了其疗效与安全性。在诱导治疗阶段,患者接受600mg静脉注射12周后,临床缓解率(CDAI<150)达到58.6%,较安慰剂组的24.7%实现超两倍的显著提升(p<0.001),同时内镜应答率(SES-CD评分下降≥50%)达40.3%,对比安慰剂组的12.1%呈现出3.3倍的绝 对优势,凸显其快速控制炎症的能力。进入维持期后,完成诱导治疗的患者转为每8周一次360mg皮下注射,至52周时,54.1%的患者实现长期临床缓解,内镜深度缓解率(SES-CD≤4且无深层溃疡)达34.2%,这一数据在慢性肠病治疗领域具有突破性意义。安全性方面,治疗组总体感染发生率为12.8%,与安慰剂组的11.9%无统计学差异(p=0.62),且未报告结核复发病例或恶性肿瘤风险增加,证实了其通过精准靶向IL-23 p19亚基、避免干扰IL-12通路的独特安全性优势。研究结果完整覆盖从急性期诱导到长期维持的治疗全周期,为克罗恩病精准治疗提供了高应答率与持久获益的双重保障。
除了疗效显著外,利生奇珠单抗的皮下注射剂型更是其一大亮点。传统的生物制剂多需要静脉输注,患者往往需要频繁往返医院,这不仅增加了患者的负担,也限制了治疗的便利性。而利生奇珠单抗的皮下剂型则允许患者在家中进行注射,每8周一次,极大地提升了治疗的便利性,这一创新剂型不仅提高了患者的治疗满意度,也为药物的商业化成功奠定了坚实的基础;艾伯维的财报显示,2024年该药全球销售额达到了117亿美元,同比增长50.9%,其中皮下剂型的贡献功不可没。
市场定位与竞争格局:差异化突围
在中国克罗恩病生物制剂市场这片竞争激烈的战场上,利生奇珠单抗面临着来自多方面的挑战。中国克罗恩病生物制剂市场已形成三足鼎立的格局:抗TNF-α药物(如修美乐)长期占据主导地位,但专利到期后受到生物类似药的冲击;IL-12/23抑制剂(如乌司奴单抗)疗效稳定,但需静脉诱导后转皮下,流程复杂且存在感染风险;而IL-23抑制剂新秀则不断涌现,如强生的古塞奇尤单抗和礼来的米吉珠单抗等。
在这样的市场环境下,艾伯维的利生奇珠单抗如何脱颖而出?其差异化优势主要体现在以下几个方面:首先,快速起效;部分患者在使用利生奇珠单抗后2周内即可观察到症状改善,这一速度明显快于其他药物如维多珠单抗(需6-8周)。其次,安全性更优;由于IL-23特异性抑制减少了感染风险,临床试验中利生奇珠单抗的感染率与安慰剂相当,为患者提供了更为安全的治疗选择。最后,双剂型覆盖;静脉注射用于急性期治疗,皮下注射则方便长期管理,形成了完整的治疗闭环。
尽管疗效显著且具备差异化优势,利生奇珠单抗的商业化之路仍需跨越重重挑战,其中的高价问题尤为突出。据估计,该药物的年治疗费用预计在15万元左右,高于乌司奴单抗(12万元)和维多珠单抗(10万元);如何说服医生和患者为高价买单成为艾伯维面临的一大难题。为此,艾伯维可能会采取多种策略:一是通过医保谈判降低价格;参考乌司奴单抗2023年降价58%进入医保的先例,利生奇珠单抗或需将年费用压至8万-10万元以争取医保覆盖;二是推出患者援助计划,通过分期付款或赠药等方式降低患者的自费压力;三是加强医生教育,借助KOL(关键意见领袖)推广IL-23靶点的精准治疗优势,提高医生对药物的认知度和接受度。
行业变局:本土药企的追赶与机遇
利生奇珠单抗的获批无疑将刺激本土创新药研发领域的发展。目前,已有两家本土药企(信达生物和康方生物)的IL-23抑制剂进入了II期临床阶段,预计将在2026年后上市。这些本土药企在成本控制和医保准入方面具备更大的灵活性,但也需要突破原研药的数据壁垒以赢得市场的认可。
与此同时,跨国药企也在加速在华布局。强生通过古塞奇尤单抗抢占先机,礼来、辉瑞等也在积极推进同类药物的研发。未来3-5年,克罗恩病治疗市场或将从“抗TNF-α时代”转向“IL-23靶点混战”,这一趋势为患者提供了更多的治疗选择,为整个行业带来了更为激烈的竞争和更为广阔的发展空间。
结语
利生奇珠单抗的获批,不仅是艾伯维继修美乐后的又一增长引擎,更是中重度克罗恩病患者的福音;但其商业化成功需跨越高价壁垒、医生认知差异和竞品挤压三重挑战,随着精准医疗和医保谈判的推进,这款药物有望改写中国克罗恩病治疗指南,推动诊疗水平与国际接轨。对患者而言,选择多了总是好事;对企业而言,真正的胜利在于让药物触达更多需要的人;这场由IL-23抑制剂引发的市场变局,或许才刚刚开始。
参考文献:
[1]d'Haens G, Panaccione R, Baert F, et al. Risankizumab as induction therapy for Crohn's disease: results from the phase 3 ADVANCE and MOTIVATE induction trials[J]. The Lancet, 2022, 399(10340): 2015-2030.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57