2025年3月14日,信达生物宣布,其自主研发的重组抗胰岛素样生长因子1受体(IG F-1R)抗体——替妥尤单抗N01注射液(商品名:信必敏®)获得国家药品监督管理局(NMPA)批准,用于治疗甲状腺眼病(Thyroid Eye Disease, TED)。
这一批准标志着中国在甲状腺眼病治疗领域取得了重大突破,填补了国内70年来该领域的治疗空白,也为患者带来了全新的治疗选择。

图1. 替妥尤单抗N01注射液获批截图,来源:NMPA官网
01
关于甲状腺眼病及其疗法
甲状腺眼病是一种与甲状腺疾病密切相关的器官特异性自身免疫性疾病,主要累及眼部组织,是成人中最常见的眼眶疾病之一。该病多见于40至60岁人群,女性发病率约为16/10万人,男性为2.9/10万人。
甲状腺眼病的典型症状包括眼球突出、复视、眼睑退缩、眼眶软组织水肿等,严重者可导致视力下降甚至失明。此外,该病还对患者的外观和心理健康造成严重影响,给患者带来沉重的心理负担。
传统治疗方案中,糖皮质激素静脉冲击治疗是中重度活动性甲状腺眼病的一线选择,但其对眼球突出的改善效果有限,且存在诸多副作用。二线治疗包括再次激素冲击、联合眼眶放疗或其他免疫调节剂,但整体疗效仍不理想。
近年来,随着对甲状腺眼病发病机制的深入研究,靶向IG F-1R的生物制剂逐渐成为新的治疗方向,并被纳入多项临床治疗指南。
02
中国首个IG F-1R抗体药物
信必敏®(替妥尤单抗)是中国首个获批的IG F-1R抗体药物,也是全球第二款获批用于甲状腺眼病治疗的同类药物。IG F-1R是一种跨膜酪氨酸激酶受体,在甲状腺眼病患者的成纤维细胞、B细胞和T细胞中过表达。替妥尤单抗通过阻断IG F-1R信号通路,抑制炎症因子的表达,减少透明质酸和其他糖胺聚糖的合成,从而减轻炎症反应,改善眼球突出、复视等症状。
01临床试验数据积极
替妥尤单抗的获批基于一项多中心、随机、双盲、安慰剂对照的II/III期临床研究(RESTORE-1)。该研究结果显示,在治疗24周时,替妥尤单抗组患者眼球突出应答率(眼球突出度回退≥2mm且且不伴有对侧眼突眼度增加 ≥2mm 的受试者比例)高达85.8%,显著优于安慰剂组的3.8%。
此外, 研究的关键次要研究终点如研究眼的眼球总体应答率(研究眼相对于基线突眼度回退≥2mm及研究眼临床活动性评分改善≥2分的受试者比例)、研究眼临床活动性评分(CAS)为0或1的受试者百分比、研究眼的眼球突出度较基线的改变等均顺利达成,IBI311(替妥尤单抗)对上述指标的改善显著优于安慰剂组。
在整个研究期间,替妥尤单抗的安全性良好,未发生严重不良事件。
02
剂型改良
信达生物相关负责人介绍,美国上市的替妥尤单抗为冻干粉针剂,而此次获批的信必敏是经过剂型改良的注射液水针,具有更好的稳定性、更低的成本和更高的患者依从性,还提高了治疗的便利性和可及性。
03
关于信达生物
信达生物成立于2011年,是一家专注于肿瘤、自身免疫、代谢及心血管、眼科等重大疾病领域的创新型生物制药公司,公司致力于通过创新研发满足未被满足的临床需求。
信达生物目前已有15款产品获批上市,涵盖肿瘤、自身免疫、代谢和眼科等多个领域。其中,信迪利单抗注射液(达伯舒®)、贝伐珠单抗注射液(达攸同®)等产品已成为国内市场的主流选择。此外,信达生物还有多个产品处于临床开发阶段,包括抗VEGF/补体的IBI302、VEGF-C/VEGF-A的IBI333等。

图2. 达伯舒®、达攸同®研发进展详情,来源:信达生物官网
除此之外,信达生物还与礼来、罗氏、赛诺菲等国际药企建立了广泛的战略合作关系,共同推动创新药物的研发和商业化。
04
持续创新与多维布局
替妥尤单抗的获批是信达生物在眼科领域的重大突破,也标志着公司在重大疾病治疗领域迈出了坚实的一步。相信信达生物将继续深耕肿瘤、自身免疫、代谢及心血管、眼科四大治疗领域,推动更多创新药物的研发和上市。未来,信达生物或将进一步拓展国际市场,通过与全球合作伙伴的紧密合作,将更多高质量的生物药推向全球。
信达生物在眼科领域的布局不仅限于替妥尤单抗。公司目前还有多个眼科产品处于临床开发阶段,包括IBI302(抗VEGF/补体)、IBI333(VEGF-C/VEGF-A)等。这些产品的研发将进一步丰富信达生物的眼科产品管线,为更多眼科疾病患者带来希望。

图3. 信达眼科管线研发进展,来源:信达生物官网
在肿瘤领域,信达生物将继续以信迪利单抗为核心,拓展其在多种癌症治疗中的应用。同时,公司还将加速其他肿瘤产品的研发,如IBI324(VEGF-A/ANG-2)等,进一步巩固其在肿瘤治疗领域的领先地位。
在代谢领域,信达生物的玛仕度肽作为国内创新双靶GLP-1药物,研发进展领先。未来,信达生物将继续推动该药物的研发和上市,为糖尿病和肥胖症患者提供更有效的治疗选择。
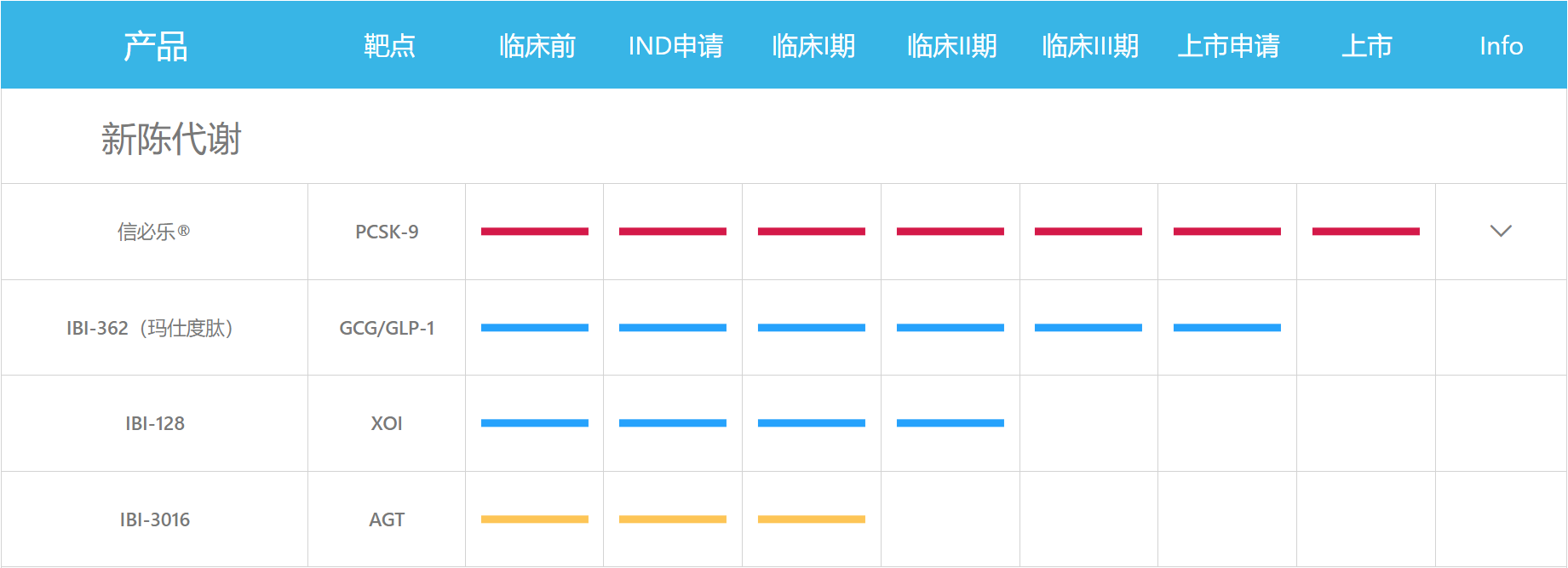
图4. 信达代谢管线研发进展,来源:信达生物官网
结 语
信达生物替妥尤单抗的获批上市,不仅为甲状腺眼病患者带来了全新的治疗选择,也为国内眼科治疗领域注入了新的活力。
这一成就的背后,是信达生物多年来在创新研发领域的持续投入和不懈努力。我们期待信达生物在未来的研发道路上取得更多突破,为人类健康事业做出更大的贡献。
参考资料
1.Hiromatsu Y, Eguchi H, Tani J, Kasaoka M, Teshima Y. Graves' ophthalmopathy: epidemiology and natural history. Intern Med. 2014;53(5):353-60.: Burch HB, et al. Management of thyroid eye disease: a Consensus Statement by the American Thyroid Association and the European Thyroid Association. Eur Thyroid J. 2022;11(6):e220189.
2.中华医学会眼科学分会眼整形眼眶病学组, 中华医学会内分泌学分会甲状腺学组. 中国甲状腺相关眼病诊断和治疗指南 (2022年). 中华眼科杂志.2022;58(9).
3.Bartalena L, Kahaly GJ, Baldeschi L, et al. The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. Eur J Endocrinol.2021;185(4):G43-G67.: Li Z, Cestari D M, Fortin E. Thyroid eye disease: what is new to know? Curr Opin Ophthalmol. 2018;29(6):528-534.
4.Ali F, Chorsiya A, Anjum V, Ali A. Teprotumumab (TEPEZZA): from the discovery and development of medicines to USFDA approval for active thyroid eye disease (TED) treatment. Int Ophthalmol. 2021;41(4):1549-1561.
5.Douglas RS, Naik V, Hwang CJ, et al. B cells from patients with Graves’ disease aberrantly express the IG F-1 receptor: implications for disease pathogenesis. J Immunol 2008;181:5768-5774.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57