2025年4月8日,中国国家药监局药品审评中心(CDE)官网公示,礼来申报的1类新药Imlunestrant片上市申请获得受理。Imlunestrant是一款口服选择性雌激素受体降解剂(SERD),此次申报的适应症为既往接受内分泌治疗的雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-) 晚期或转移性乳腺癌患者。
此前,该药物的3期临床研究已经取得积极结果,显示出良好的疗效和安全性。此次在中国的上市申请获得受理,意味着其在中国的临床研发进程迎来了新的里程碑,有望为中国乳腺癌患者提供一种全新的治疗方案。
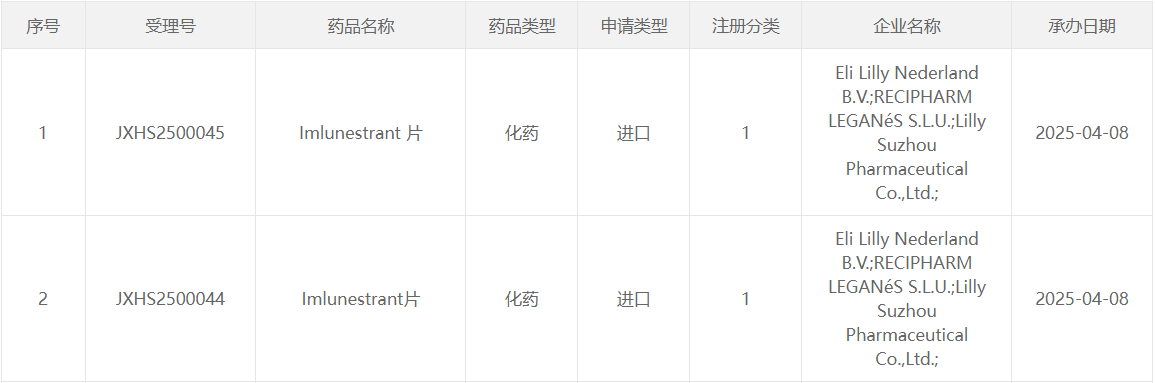
图1. Imlunestrant片上市申报获受理,来源:CDE官网
01
关于乳腺癌与现有疗法
乳腺癌是全球女性中最常见的恶性肿瘤之一,其发病率和死亡率均居高不下。全球乳腺癌患者人数庞大,据相关统计数据显示,2022年全球乳腺癌新发病例数为230万例,其中雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)乳腺癌是最常见的亚型,占所有乳腺癌患者的约70%。在中国,乳腺癌的发病率也呈现逐年上升的趋势,给患者及其家庭带来了沉重的负担。
ER+、HER2-乳腺癌的肿瘤细胞依赖雌激素受体(ER)来促进生长。传统的内分泌治疗通过抑制雌激素的合成或阻断ER的活性来抑制肿瘤生长,但许多患者在治疗过程中会出现耐药现象,导致疾病进展。ESR1突变是乳腺癌患者内分泌治疗耐药的主要变异形式,尤其在晚期乳腺癌患者中,其发生率高达20%~50%。因此,开发能够有效抑制ER活性且克服耐药问题的新药物,一直是乳腺癌治疗领域的研究热点。
目前,乳腺癌的治疗主要包括手术、放疗、化疗、内分泌治疗和靶向治疗等多种方式。对于ER+、HER2-乳腺癌患者,内分泌治疗是主要的治疗手段之一。然而,传统的内分泌治疗药物如芳香化酶抑制剂和选择性雌激素受体调节剂(SERM)在长期使用过程中,往往会面临耐药问题,导致治疗效果下降。ESR1突变是导致内分泌治疗耐药的主要原因之一,尤其是在晚期乳腺癌患者中,其发生率较高。因此,开发能够克服耐药问题的新药物,一直是乳腺癌治疗领域的研究重点。
02
Imlunestrant作用机制
雌激素受体(ER)在乳腺癌的发生和发展中起着关键作用。ER是一种核受体,当雌激素与其结合时,ER会进入细胞核,调节基因的转录,从而促进细胞增殖和生存。在ER+乳腺癌中,肿瘤细胞依赖ER的活性来维持生长。因此,抑制ER的活性是治疗ER+乳腺癌的重要策略之一。
Imlunestrant是一种口服SERD,其作用机制是通过与雌激素受体(ER)结合,引发ER的结构变化,使得细胞内的E3泛素连接酶能够更好地识别并标记ER,最终导致ER被细胞的蛋白酶体降解。与传统的内分泌治疗药物相比,Imlunestrant具有独特的优势:
1
穿透血脑屏障
Imlunestrant能够穿透血脑屏障,这对于预防和治疗乳腺癌脑转移具有重要意义。乳腺癌脑转移是晚期乳腺癌患者常见的并发症之一,传统的内分泌治疗药物往往难以有效穿透血脑屏障,导致治疗效果受限。
2
持续抑制ER活性
Imlunestrant的设计目标是无论ESR1突变状态如何,均能够在整个给药期间持续抑制ER靶点的活性。这使得Imlunestrant能够有效克服ESR1突变导致的耐药问题,为晚期乳腺癌患者提供更持久的治疗效果。
3
低毒性
在临床试验中,Imlunestrant显示出良好的耐受性,其毒性较低,患者的不良反应较少。这使得患者能够更好地耐受长期治疗,提高治疗的依从性。
03
临床试验数据情况
Imlunestrant的1期临床试验(EMBER研究)结果显示,无论是单药治疗还是与CDK4/6抑制剂阿贝西利(abemaciclib)联用,Imlunestrant在ER+乳腺癌患者中均显示出低毒性、良好的药代动力学特性和抗肿瘤活性。这为后续的临床试验奠定了坚实的基础。
2024年12月,礼来宣布其3期临床试验EMBER-3取得积极结果。EMBER-3是一项随机、开放标签试验,旨在评估Imlunestrant、研究者选择的标准内分泌治疗(SOC ET)以及Imlunestrant联合CDK4/6抑制剂阿贝西利在ER+/HER2-局部晚期或转移性乳腺癌患者中的疗效与安全性。这些患者的疾病在使用芳香化酶抑制剂治疗后(有或无CDK4/6抑制剂)出现复发或进展。该试验共入组了874名成年患者,患者被随机分配接受Imlunestrant单药、SOC ET(氟维司群或依西美坦)或Imlunestrant联合阿贝西利治疗。
Imlunestrant对比SOC ET
在携带ESR1突变的患者中,Imlunestrant显著改善了患者的无进展生存期(PFS)。接受Imlunestrant治疗的患者中位PFS为5.5个月,而接受SOC ET治疗的患者PFS为3.8个月。Imlunestrant组患者的总缓解率(ORR)为14%,SOC ET组为8%。在所有患者中,Imlunestrant组与SOC ET组患者的中位PFS分别为5.6个月和5.5个月。
Imlunestrant与阿贝西利联合疗法对比Imlunestrant单药
联合疗法显著改善了所有患者的PFS。联合疗法组患者的中位PFS为9.4个月,而接受单药治疗的患者中位PFS为5.5个月。联合疗法对患者的PFS益处在所有患者亚群中表现一致,无论患者是否携带ESR1或PI3K信号途径的突变以及之前是否曾接受CDK4/6抑制剂治疗。联合疗法与单药组患者的ORR分别为27%与12%。
这些结果表明,Imlunestrant不仅在单药治疗中表现出色,与阿贝西利联合使用时,能够进一步提高治疗效果,为晚期乳腺癌患者提供了更有效的治疗选择。
04
市场前景展望
Imlunestrant作为一种新型的口服SERD,具有独特的作用机制和显著的临床优势。其能够穿透血脑屏障,有效抑制ER活性,并克服ESR1突变导致的耐药问题。在临床试验中,Imlunestrant无论是单药治疗还是与阿贝西利联合使用,均显示出良好的疗效和安全性。这些特点使得Imlunestrant在乳腺癌治疗市场中具有广阔的前景。
随着Imlunestrant在中国的上市申请获得受理,其有望成为中国乳腺癌治疗领域的重要补充。凭借其创新的机制和显著的疗效,Imlunestrant有望在未来的乳腺癌治疗市场中占据重要地位,为患者提供更有效的治疗选择。
除了在中国的上市申请,Imlunestrant在全球范围内的研发也在稳步推进。目前,Imlunestrant正在进行针对早期乳腺癌患者的3期辅助治疗试验EMBER-4,预计将在全球范围内招募6000名患者。此外,礼来还在多个国家和地区开展了多项临床试验,以评估Imlunestrant在不同乳腺癌患者群体中的疗效和安全性。
在中国,礼来针对Imlunestrant开展了两项3期临床研究,包括EMBER-3研究和EMBER-4研究。这些研究的开展,不仅为Imlunestrant在中国的上市提供了重要的数据支持,也为中国的乳腺癌患者带来了新的希望。
Imlunestrant的上市有望改变中国乳腺癌治疗的格局。其创新的机制和显著的疗效,使其在晚期乳腺癌治疗中具有重要的临床价值。此外,随着Imlunestrant在早期乳腺癌治疗中的研究不断深入,其有望为乳腺癌的预防和治疗提供更全面的解决方案。未来,随着更多临床试验数据的公布和市场推广的推进,Imlunestrant有望在全球乳腺癌治疗领域发挥更大的作用。
结 语
礼来乳腺癌1类新药Imlunestrant片在中国申报上市,为中国的乳腺癌患者带来了新的希望。其创新的口服SERD机制、显著的临床疗效以及良好的安全性,使其在乳腺癌治疗领域具有独特的优势。
随着临床试验的不断推进和市场认可度的提高,Imlunestrant有望在未来的乳腺癌治疗市场中发挥更大的作用,为全球乳腺癌患者带来更多的福音。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57