3月30日,礼来公布了其小干扰RNA(siRNA)疗法Lepodisiran的II期积极结果。该疗法旨在降低Lp(a)的产生,后者是心血管疾病的遗传风险因素。
研究设计为在基线和第180天各给药一次,另有一组在基线给予400mg,第180天给予安慰剂。共有320名参与者接受随机分组,基线Lp(a) 水平中位数为253.9 nmol/L。
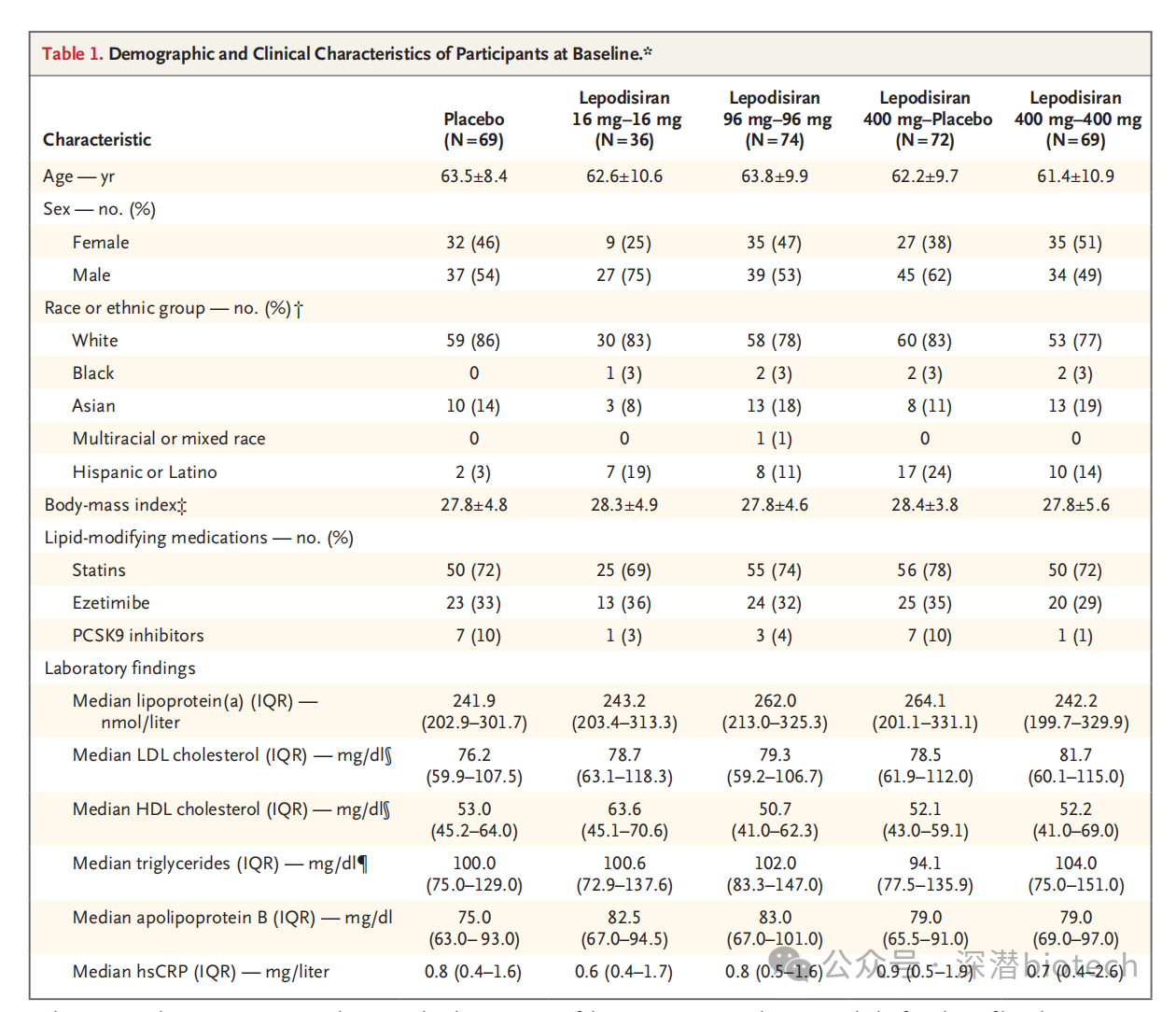
II期ALPACA研究中,Lepodisiran在接受了最高测试剂量(400mg)治疗后,60天-180天内显著降低了Lp(a) 水平,平均降低了93.9%,达到主要终点。接受Lepodisiran16mg和96mg剂量治疗的受试者,同期Lp(a)水平分别降低40.8%和75.2%。
Lepodisiran还达成多项次要终点,在为期近18个月的研究中,所有评估时间点均显示3个测试剂量(16mg、96mg、400mg)在单次或两次给药后均能降低Lp(a)水平。额外剂量的效果仍待确定。
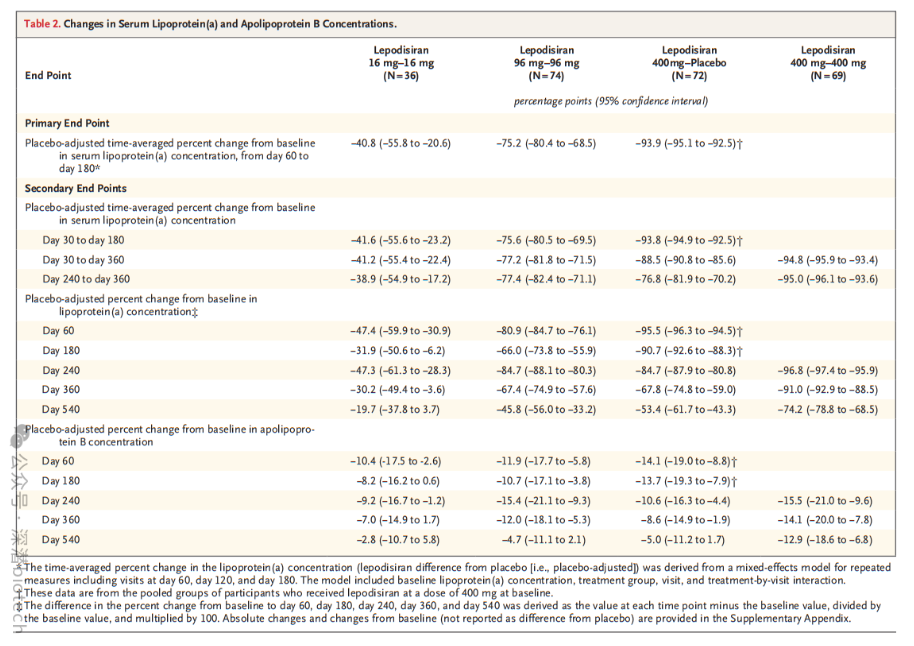
其他次要终点显示:
接受两次400mg剂量(基线和第180天)的受试者,在第30-360天期间平均Lp(a)水平降低94.8%,第360天(约1年)仍低于基线91.0%,第540天(约1.5年)比基线低74.2%。
Lepodisiran还降低载脂蛋白B(apoB)水平,这是一种单独的胆固醇生物标志物。最高剂量组(400mg)在第60天和第180天分别将apoB降低14.1%和13.7%。第180天的第2次400mg给药使这些降低效果维持至第540天。
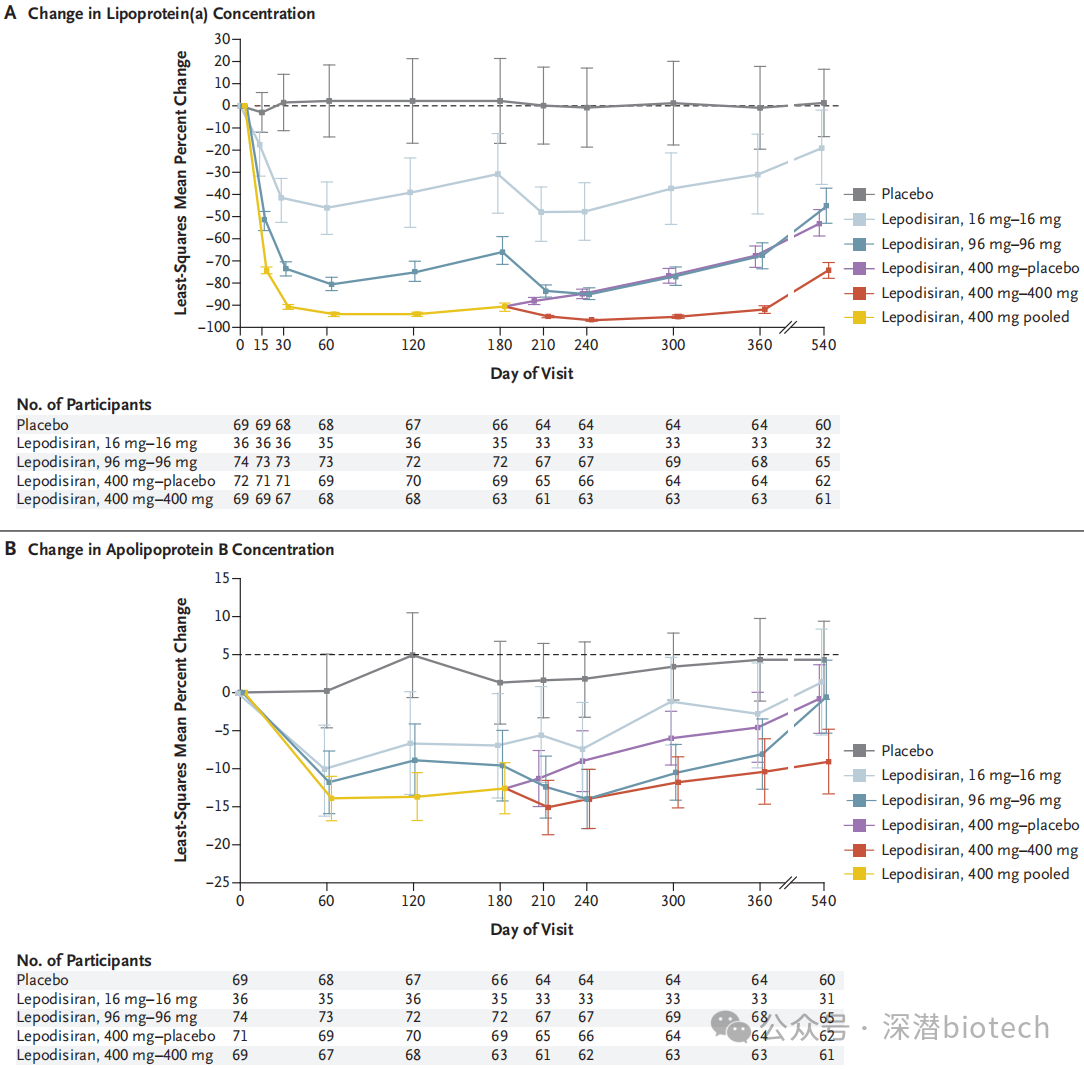
安全性方面,与研究药物相关TEAE发生率为:安慰剂组1%(1/69)、16mg组3%(1/36)、96mg组12%(9/74)、400mg混合组14%(20/141)。
未发生与Lepodisiran相关的严重不良事件。16mg组发生1例因慢性冠心病并发症导致的死亡。安慰剂组1名受试者因TEAE退出研究药物,而Lepodisiran组无受试者因TEAE退出治疗或研究。
目前,Ph3 ACCLAIM-Lp(a) 临床研究正在招募受试者,该项目旨在评估Lepodisiran降低Lp(a) 水平对成人心血管事件的影响。
升高的Lp(a)水平可使心脏病发作风险翻倍甚至3倍,并与中风、心脏瓣膜狭窄(主动脉瓣狭窄)等其他心血管问题相关。lepodisiran 是一种siRNA疗法,通过抑制载脂蛋白(a)(apo (a))的生成来降低Lp(a)水平,后者是Lp(a)的关键组成部分。
礼来糖尿病、肥胖及心血管代谢研究副总裁Ruth Gimeno表示:"长期以来,降低高Lp(a)患者的遗传心血管疾病风险一直是亟待满足的医疗需求。这些结果为开发长效治疗方案带来希望,我们将在进行中的III期心血管疾病研究中继续评估Lepodisiran的潜在益处。"
除Lepodisiran外,礼来还布局了一款口服小分子Lp(a)选择性抑制剂Muvalaplin。2024年11月,礼来一项II期研究结果表明,该潜在首 创小分子抑制剂显著降低心血管事件高风险成人Lp(a)水平,使用完整Lp(a)测定法,安慰剂调整后的降低率高达85.8%,使用apo(a)测定法,降低率高达70.0%。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57