9月26日,CDE正式公示了第二十三批拟纳入优先审评程序的药品,上个月刚刚报产的马来酸吡咯替尼赫然在列,笔者在CDE官网上查询到的相关信息如下:
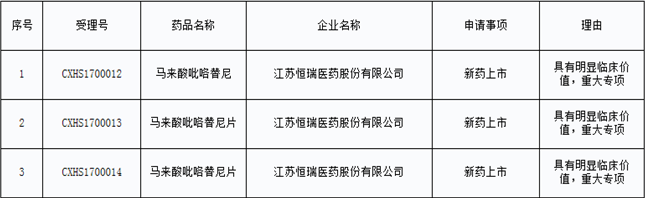
速度飞起啊!恒瑞的马来酸吡咯替尼8月24日才报产,9月26日就拿到了优先审评,年内获批上市真不是梦。值得一提的是,这个进度比之前预计的2019年上半年上市快了整整一年多。
从首次申报到报产仅耗时6年的TKI
马来酸吡咯替尼是一种口服、不可逆、泛-ErbB受体的酪氨酸激酶抑制剂(TKI),同时具有抗EGFR/HER1、HER2 以及HER4 活性。该药目前在国内登记的临床试验共有9项,Ⅰ、Ⅱ和Ⅲ期临床试验同时进行,涉及HER2表达阳性晚期或转移性乳腺癌、HER2突变晚期非小细胞肺腺癌以及HER2表达阳性晚期胃癌三种适应症,其中以乳腺癌适应症为主,已经进入Ⅲ期临床。
该药申报之路可谓神速。恒瑞于2011年5月首次申报,2012年5月首次获得临床批件,2017年8月24日报产获CDE受理,2017年9月26日获得优先审评,耗时仅仅6年时间。笔者在相关网站上查到的马来酸吡咯替尼报产受理信息如下:
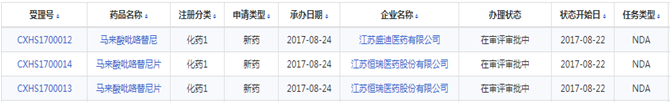
(资料来源于药智数据)
临床效果明显优于同类竞品的乳腺癌抗癌药
上个月在马来酸吡咯替尼报产时,笔者就写了一篇题为“‘口服赫赛汀’来了?!恒瑞10亿级新药马来酸吡咯替尼申报上市”的文章,有兴趣的读者可以移步去看看。这篇笔者想着重强调一下马来酸吡咯替尼以下两方面的重要优点:
一方面,马来酸吡咯替尼全球同类竞品只有两个(以乳腺癌为适应症)。目前,全球与吡咯替尼靶点相同、适应症相似的竞品分别是GSK的拉帕替尼和Puma 公司的来那替尼(勃林格殷格翰的马来酸阿法替尼靶点相同但适应症有所区别)。在药物理化性质方面,马来酸吡咯替尼是来那替尼的衍生物;在适应症方面,马来酸吡咯替尼与拉帕替尼更为接近,马来酸吡咯替尼与两个竞品的比较如下:
|
药品 |
公司 |
获批情况 |
适应症 |
优点 |
缺点 |
|
马来酸吡咯替尼 |
恒瑞 |
2017年9月26日报产获优先审评 |
联合卡培他滨治疗ErbB-2 过度表达的,治疗的晚期或转移性乳腺癌 |
已公布临床数据显示,吡咯替尼疗效优于拉帕替尼 |
预计副反应发生率介于拉帕替尼与来那替尼之间 |
|
拉帕替尼 |
GSK |
2007年3月获FDA批准,2013年1月进入中国 |
联合卡培他滨治疗ErbB-2 过度表达的,既往接受过包括蒽环类、紫杉醇、曲妥珠单抗(赫赛汀)治疗的晚期或转移性乳腺癌 |
相比赫赛汀等大分子单抗药物,小分子靶向药物更容易穿过血脑屏障,治疗转移性乳腺癌 |
疗效不够突出、副反应较大 |
|
来那替尼 |
Puma |
2017 年7月获FDA批准,暂未进入中国 |
用于Her2过表达、曲妥珠单抗辅助治疗后的维持治疗 |
能够明显降低乳腺癌的复发风险 |
39%的3级腹泻副反应 |
另一方面,马来酸吡咯替尼临床效果明显优于拉帕替尼。恒瑞一项 I 期临床结果显示,马来酸吡咯替尼联合卡培他滨治疗Her2阳性晚期乳腺癌无进展生存期(PFS)为35.4 周,而拉帕替尼早期公布的临床数据约 27 周,可见马来酸吡咯替尼临床效果明显由于拉帕替尼。
此外,有业内人士从时间点及临床患者入组需要耗时等多方面考虑,认为该药2016 年及之后登记的II、III期临床试验目前应该没有完成。报产很大可能是基于2015年6月登记的“马来酸吡咯替尼片联合卡培他滨对比拉帕替尼联合卡培他滨治疗HER2表达阳性转移性乳腺癌的 I/II 期临床研究”。
市场规模有望“10亿”级的恒瑞第三大创新药
马来酸吡咯替尼适应症以乳腺癌为主,并且在进行胃癌和肺癌的临床研究。有业内人士从乳腺癌、胃癌和其他肿瘤适应症发病率以及马来酸吡咯替尼使用成本等因素考虑,分析该药年销售额有望超过10亿元,市场潜力巨大。若顺利获批上市,马来酸吡咯替尼将成为恒瑞继艾瑞昔布、阿帕替尼后第三个上市的重大创新药。笔者将密切关注马来酸吡咯替尼上市获批情况,请亲们等我哦。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57