15日,江苏恒瑞医药股份有限公司发布公告,公司旗下贝伐珠单抗注射液的Ⅲ期临床试验即将开展,至此恒瑞顺利跻身国内贝伐珠单抗生物类似物开发的Ⅲ期临床队列。
目前,国内的制药企业中均无同类产品获批上市。据不完全统计,截至发文日期手握贝伐珠单抗生物类似物临床试验批文的国内制药企业数量超过了20家,其中在研产品已经处于Ⅲ期临床试验阶段的国内制药企业有7家,见下表。
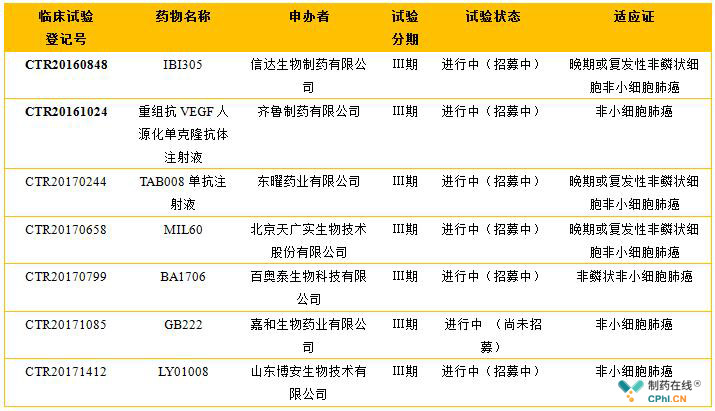
除了嘉和生物药业的Ⅲ期临床试验处于"进行中 (尚未招募)"阶段之外,其他6家的临床试验均处于"进行中(招募中)"的阶段。
与信达生物、齐鲁制药等较早开展Ⅲ期临床试验的国内企业相比,恒瑞在这款生物类似物的竞争格局中显然慢了几步,然而,换个角度来看,恒瑞旗下这款在研产品Ⅲ期临床的开展也意味着公司在生物类似物领域的全新布局;再者,考虑到"研发一哥"在国内临床试验管理以及肿瘤产品线商业化方面一流的实力,恒瑞的加入势必使得早已经熙熙攘攘竞技场变得更加热闹非凡,未来国内贝伐珠单抗生物类似物市场的角逐也更加值得期待。
多面手的贝伐珠单抗
由罗氏子公司基因泰克和中外制药合作开发的贝伐珠单抗是一种人源化的抗-VEGF 单克隆抗体,FDA于2004 年批准了该药物的上市申请,商品名为阿瓦斯汀(Avastin)。最新的数据显示,2017 年阿瓦斯汀全球市场的销售额为 68.08亿美元,其中中国市场贡献的销售额为1亿美元,占比大约为1.5%。
目前,由安进和 Allergan共同开发的Mvasi已经于今年1月在欧盟获得了批准,FDA批准的时间是在去年9月,这是首个进入市场的阿瓦斯汀生物仿制药,在中国市场销售的同类药物只有罗氏公司的阿瓦斯汀,原研药物的中国专利将于2018 年到期。
早在2004年获得FDA批准之初,阿瓦斯汀的适应证为转移性结直肠癌,在随后的多年中阿瓦斯汀又陆续增加了非小细胞肺癌、恶性胶质瘤、转移性肾细胞癌、宫颈癌和卵巢癌等多种新的适应证,这款药物是抗肿瘤药物领域典型的"多面手"。
不难发现,在目前国内制药企业贝伐珠单抗生物类似物的开发路径之中,临床试验阶段的适应证几乎都是集中于非小细胞肺癌这一细分的疾病领域,在临床试验的设计及内容方面多以在研生物类似物联合紫杉醇、卡铂等化疗药物进行治疗。值得一提的是,正大天晴集团登记号为CTR20171308的一项临床试验探索的适应证为结直肠癌、肺癌、卵巢癌、宫颈癌、胶质母细胞瘤等多种肿瘤,在众多同台竞技的国内制药企业中独树一帜。
联合用药潜力大
在2017年全球最畅销药物的排行榜中,Avastin(贝伐珠单抗)以68.08亿美元的销售额位列榜单第6名,已经持续多年进入了TOP 10的序列,该产品为罗氏公司带来了源源不断的现金流,对于罗氏现有业绩的维持可谓功不可没。
目前在结直肠癌、肾癌、非小细胞肺癌等多种适应证的治疗上,与化疗、PD-1/L1 单抗、厄洛替尼等多种单抗以及小分子药物的联合使用能够取得良好的临床数据。以与罗氏未来的明星药物PD-L1 单抗 Atezolizumab 联用为例,2017 年ASCO 公布的II 期临床数据显示,Atezolizumab 联用贝伐珠单抗的数据略优于舒尼替尼单药治疗,目前Atezolizumab 联用贝伐珠单抗的Ⅲ期临床试验已经开展;而在典型的非小细胞肺癌治疗领域,罗氏正还在大力推进贝伐珠单抗与化疗药物+PD-1/L1 联用的治疗方案,其中IMpower 150 研究的初步结果显示这中联合用药方案也有望成为一线疗法。

作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57