
近日,华海药业发布公告,旗下非布司他片的新药简略申请(ANDA)已获得了FDA的暂时批准。
非布司他片主要用于痛风的治疗。2017年该品种在美国市场的销售额大约为5.4亿美元,现有在售产品只有Tekeda的原研产品。目前,非布司他片在美国尚处于专利保护期内,FDA已经完成了对华海非布司他片安全性和有效性的审评,鉴于专利权的原因目前给与了非布司他片暂时批准。
海外市场和国内市场良性互动 业绩骄人
此次非布司他片拿下美国ADNA暂时批准,这是2018年以来华海药业在美获批的第四个ANDA产品。前3个ANDA品种分别为坎吡格列酮片、地沙坦酯氢氯噻嗪片以及氯吡格雷片。
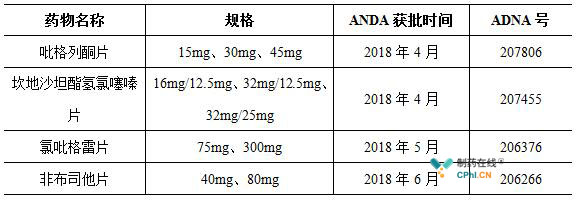
2017年,华海药业实现营业收入50亿元,同比增长22%,业绩超过市场预期。这一年华海药业在国际市场和国内市场都收获颇丰:国外市场中,华海向FDA申报了13个产品,获得10个ANDA批准文号,新产品申报以及获批准数均创下了历史新高;国内市场中,2017年底,华海药业共计9个品规的7个产品通过了仿制药质量和疗效的一致性评价,成为国内首批通过一致性评价制药企业中的赢家。
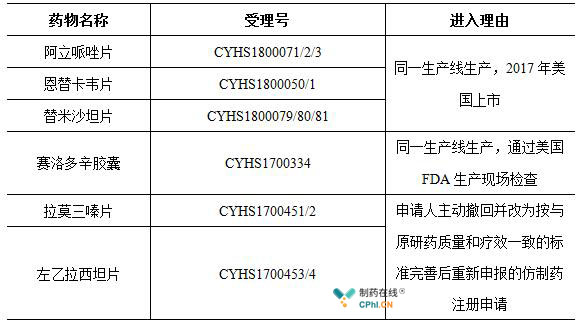
2018年至今,除了拿下上述4个ADNA产品之外,在近日国家药监局审评中心发布的《拟纳入优先审评程序药品注册申请的公示(第二十九批)》中,华海药业阿立哌唑片、恩替卡韦片、替米沙坦片、赛洛多辛胶囊、拉莫三嗪片、左乙拉西坦片进入该名单,在共计44个受理号中以6个受理号位居榜首。
目前,华海药业海外获批品种和国内优审品种已形成了良性循环,公司出口品种在国内获益效果已经显现,这包括国内转报品种被纳入优先审评以及出口共线产品快速通过一致性评价等。从长远来看,未来公司在中美两大市场的产品线有望不断丰富。
在研储备丰富 未来可期
2018年第一季度,华海药业实现营业收入12.39亿元,同比增长9.69%,在美国的制剂销售依然保持了高速增长。海外制剂的上市销售产品共计48个,其中15个产品保持了市场领先优势。
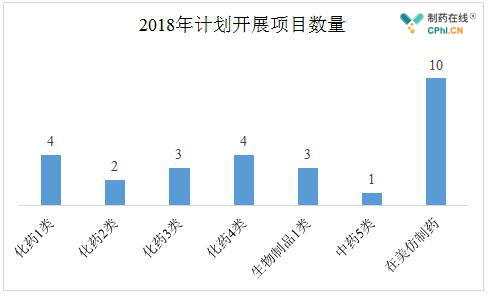
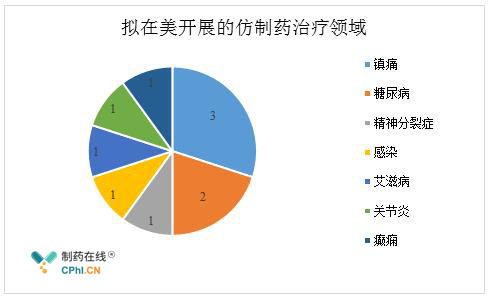
目前,华海药业在2018年计划开展的重要研发项目共计27个,其中有10个项目计划在美国开展。据相关业内人士预计,2018年华海在美国获批的ANDA产品数据有望达到10个左右,可能会涉及到的治疗领域包括糖尿病、艾滋病、感染以及**分裂症等方面。
随着近年来华海药业在特色仿制药、首仿药以及高端仿制药等仿制药品种方面产品管线的不断升级,公司将逐步形成自身在仿制药领域的独特优势。尤其值得一提的是,华海药业在研管线中的多个仿制药项目均涉及到了专利挑战的内容,且占比不低,借鉴国内首个PIV专利挑战成功的仿制药帕罗西汀胶囊的经验,凭借着华海药业已经建立起来的有效专利诉讼体系,未来华海有望通过专利挑战的方式在海外市场中获得更多的首仿药物品种。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57