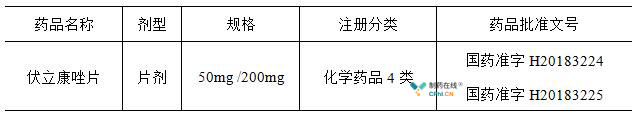
近日,华海药业发布公告,公司旗下4类仿制药伏立康唑片的生产申请获得了国家药品监督管理局批准。至此,华海药业第二款制剂出口转报国内上市的产品获批。
第二个制剂出口转报国内上市的产品
伏立康唑是一种广谱三唑类抗真菌药物,原研产品属于辉瑞公司。2002年,辉瑞的伏立康唑片获得了FDA批准上市,2004年在我国进口上市。目前,国内市场在售的产品厂家包括了北京博康健基因科技有限公司以及成都华神集团股份有限公司制药厂,在国内的市场中原研产品的市场占比超过了50%。
华海药业伏立康唑片于2016年获得了美国市场的ANDA批文。根据FDA橙皮书的公开信息,目前在美国经FDA批准的伏立康唑仿制药生产厂家共有11家,包括了梯瓦、山德士等仿制药巨头公司,市场竞争激烈。
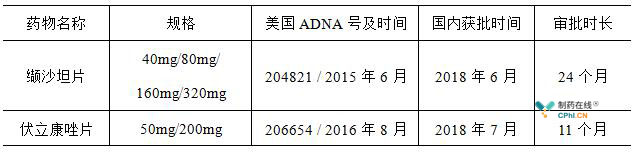
2017年11月,CDE受理了华海药业伏立康唑片仿制药的国内上市申请,随后该申报产品凭借着"同一条生产线生产,2016年美国上市"被纳入到了第25批优先审评审批名单中。从申报生产到国内获批上市历时11个月。
从国内获批上市的路径来看,华海药业伏立康唑片是典型的制剂出口转报国内上市的产品。华海药业旗下的缬沙坦片于今年6月在国内获批上市,是首个制剂出口转报国内成功上市的产品,此次获批的伏立康唑片是华海药业继缬沙坦片之后又一款通过海外转报顺利在国内获批的品种。
海外出口转报国内产品丰沛 华海进入收获期
截至目前,华海药业的ANDA文号总数超过50个,公司多年来坚持的制剂国际化战略在海外收获颇丰,这也是华海药业海外制剂出口产品转报国内上市的坚实基础。
自2015年以来,随着国家鼓励性政策的相继出台,我国制药企业"在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请"的品种逐步会享受到在注册申报、一致性评价、医保支付以及招标采购等方面多重的政策利好,华海药业凭借着政策东风,旗下储备丰富的制剂国际化产品回归国内市场自然就成为了水到渠成的事情。
截至发稿日,CDE发布了29批拟纳入优先审评程序药品注册名单,拟纳入优先审评程序的受理号共计505个。除了上述提到的缬沙坦片以及伏立康唑片之外,华海药业旗下的制剂出口产品凭借"在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请"进入CDE优先审评程序的药物还包括了左乙拉西坦片、盐酸多奈哌齐片以及缬沙坦氢氯噻嗪片等7个药物品种。
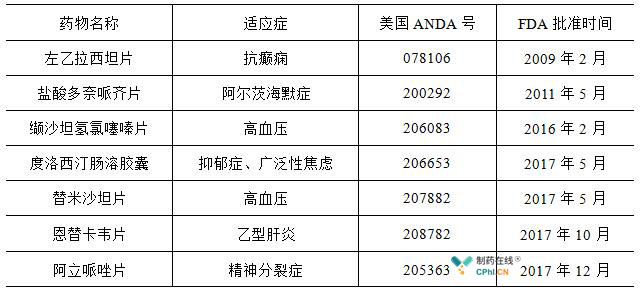
凭借着上述这些纳入到优先审评程序的制剂出口转报国内的产品,华海药业引领了国内本土制药企业制剂出口品种回归国内的新潮流,并将陆续在国内收获多个产品,公司将从制剂国际化以及制剂出口转报国内的战略中持续获益。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57