3月6日,罗氏向FDA提交了抗流感新药Xofluza补充上市申请,拟用于流感高危群体的治疗。
2018年10月,基于CAPSTONE-1 III期临床研究结果,FDA批准了日本盐野义制药公司和罗氏联合研发的抗流感新药Xofluza上市上市申请,用于12岁及以上无并发症急性流感患者的治疗,这是近20年来FDA首次批准的新型抗病毒流感治疗方法。
罗氏对Xofluza寄予厚望,希望该药物能延续达菲的销售业绩。
流行性感冒
流行性感冒是流感病毒引起的急性呼吸道感染,在流行病学上最显著的特点为突 然爆发、迅速扩散。相较于普通感冒,流感具有传染性强、季节性明显、多高热、 疼痛感强、易出现并发症等特点。
根据WHO及柳叶刀的研究,全球每年大约有5%-10%的成年人和20%-30%的儿童罹患季节性流感,约300-5000万发展为重症病例,多达30-64.6万人死于季节性流感的呼吸系统疾病,我国每年感染流感的人数可达到 0.65-2亿人。
流感病毒是一种小型RNA病毒,人流感病毒分为甲、乙、丙三型,其中乙型流感只感染人类,近年来流行的Yamagata和Victoria系就属于乙型流感病毒。
奥司他韦 目前使用最为广泛的流感抗病毒 药物
奥司他韦是由吉利德研发、罗氏全球商业化的一款神经氨酸酶抑制剂,对甲型和乙型流感、H5N1 和 H1N1 等亚型流感病毒引发的流感均有治疗和预防的作用。 药物进入人体后,可以阻止病毒颗粒的释放,切断病毒的扩散链,控制流感病程,缓解病人高热症状。1999 年,原研奥司他韦获得FDA 批准上市,商品名为达菲。
WHO推荐奥司他韦为基本药物,美国和欧洲 CDC也相继将其推荐为主要的抗流感病毒 药物。鉴于较高的安全性,FDA 批准奥司他韦为超过 14 天新生儿治疗流感的唯一药物。
2002年达菲进入我国市场,其核心专利已于2017年到期。在我国抗甲型流感病毒的首选化药为奥司他韦和扎那米韦,其中奥司他韦占据了主导地位。
东阳光药可威国内一枝独秀
2006年,经过罗氏授权,上海医药子公司和东阳光药的奥司他韦胶囊分别以商品名奥尔菲和可威上市,实现国产化。
2012年后,东阳光药可威崛起,奥司他韦国内销售额实现爆发式增长。
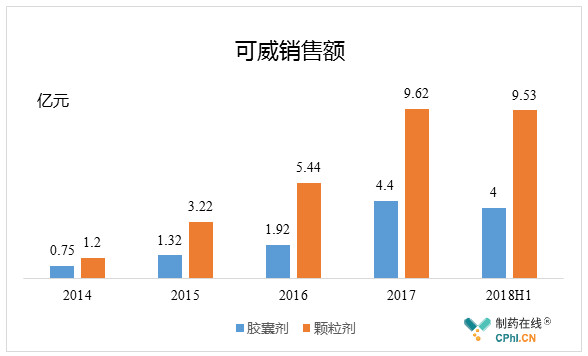
目前,在国内的神经氨酸酶抑制剂领域,东阳光药凭借着可威的销售一枝独秀,占据了大部分的市场份额。
可威拥有胶囊和颗粒剂两种剂型,其中颗粒剂是东阳光药的独家剂型,于2008 年获批上市,目前市场上的磷酸奥司他韦颗粒剂仅有东阳光药一家获得生产批文,专利保护期至2026 年。
颗粒剂适合有吞咽困难的患者和儿童服用,同时也易调整剂量,在市场上更受欢迎,销售额远超过胶囊剂,并于 2017 年进入新版全国医保目录。
竞品技高一筹
在CAPSTONE-1 III期临床研究中, Xofluza在改善流感症状持续时间(TTIIS)及发热减少方面与奥司他韦表现出相似的疗效,但在病毒排出停止时间方面Xofluza更胜一筹。
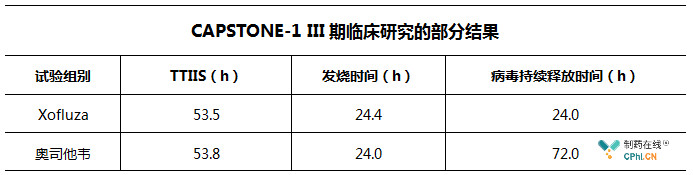
除了疗效方面的优势之外,相比于奥司他韦,Xofluza只需口服一次,前者则需要患者每日服用2次,并且持续服用5天。
此次,基因泰克向FDA递交了Baloxavir marboxil的补充新药上市申请,该申请是基于CAPSTONE-2全球性III期临床研究,该试验用以评估Xofluza在12岁及以上流感并发症高危人群中疗效和安全性,已达到了主要临床终点。
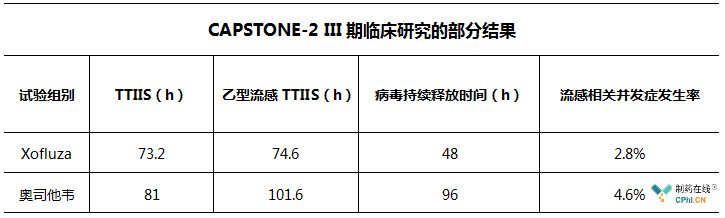
根据美国CDC的定义,流感高危人群指年龄为65岁及以上的老年人、或患有哮喘、慢性肺病、肥胖、心脏病等疾病的群体。
据估计,FDA将在今年11月4日对这一补充上市申请做出决定,Xofluza有望因此成为全球首个用于流感高危群体的治疗药物。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57