
写在最前:其实如果就单单写FDA的成长,在IV中已经写完,如果关于Hatch-Waxman法案,那么到VII也差不多结束了。再写这一篇,不是为了凑个吉利数,弄个8篇连载。伯爵是想在和大家说一下,美国国会后续出台的几个法案用于修补H-W法案随着时间的发展,出现的不适应,以及到目前为止都没有解决掉的美国仿制药的问题。同时在文章最后,也想占用一些篇幅和各位分享一点自己的看法。
该系列相关阅读:
蜕变的白头鹰(VIII)
--从混乱之治到冰封王座
八. 未来已来
经历了一系列风波后,美国的制药行业至少在法规层面和执行角度走上了正轨,但是监管机构和被监管行业永远是在规则内玩着某种程度的猫鼠游戏。虽然整个仿制药行业被Hatch-Waxman法案领上道了,但是在二十世纪九十年代中期,面对飞速发展的自由经济市场,FDA的监管以及Hatch-Waxman法案继续收到了来自法规本身的挑战。下面伯爵就找几个比较有代表性的问题,和大家分享一下:
30个月专利诉讼期的滥用
根据Hatch-Waxman法案中专利链接部分的要求,如果原研药企业起诉仿制药公司专利侵权,那么FDA必须立刻停止对该仿制药的审评,直到专利官司打完或者等30个月。这样就给原研药企一个很大的空子可以钻。
• 1989年阿斯利康著名的胃食管反流药物奥美拉唑,在国内叫洛赛克,在美国叫做Prilosec批准上市,其专利在2001年到期。在这个过程中,阿斯利康不停为洛赛克申请额外专利,直接将专利保护延长至2019年,并且在2000年开始,通过洛赛克的各种专利保护,不停和仿制药公司打官司,伯爵查了一下橙皮书,洛赛克的仿制药基本都是在2010年以后上市,只有Santarus公司通过改剂型的方法,按照505(b)2的要求,申报了NDA,才在2004年上市。这些乱七八糟的专利就好像黄蓉身上一层层的软猬甲,搞得欧阳克们有贼心没贼胆,碰上杨康这种不知好歹,暗中偷袭的,最后把命都丢了。那些仿制药公司觊觎洛赛克,结果去碰一下,就被阿斯利康拉到联邦巡回法院去过热堂,阿斯利康财大气粗,有的是钱,能折腾,仿制药公司小门小户,专利律师请几次,公司一个季度的销售额可能就没了。
• 另外一个例子,也是英国制药巨头GSK,当时它的产品盐酸帕罗西汀,中文商品名赛乐特,被加拿大制药公司Apotex仿制,GSK很轻松就为赛乐特穿了九件软猬甲,并且把可怜的Apotex连续上诉5次,这个产品的市场独占期直接延长了5年半,65个月。Apotex自己反而被弄得焦头烂额,而其他想仿制这个产品的公司都在背后骂Apotex这个坑货,不仅白白送给GSK多出来的65个月时间,还把小伙伴们都坑了。
180天独占期交易
如果你不能打败对手,那就和他联合。--Peter Thiel《从0到1》作者,Paypal创始人
"交易是最常见的经济行为,而交易的本质是价值的交换,直接体现为以货币为媒介或者以物易物--马克思主义政治经济学"。180天的独占期交易直接来说就是原研药公司向获得独占期的首仿药公司支付一定报酬,暂缓首仿药上市,这个在美国被称为Pay for delay,或者和首仿药公司签署逆向和解协议(Reverse Payment Agreement)。这一招不仅仅可以缓解首仿药市场独占期对原研药的冲击,同时还有更加狠毒的后招,根据Hatch-Waxman法案的要求,如果首仿药6个月的独占期没有开始,FDA就不能批准其他仿制药上市,而这就相当于6个月的独占期是给了原研药公司。当然,原研药公司的Pay for delay也是开价不菲,报酬至少是首仿药公司在6个月独占期内可预期的销售额的两倍,但是哪怕开价到两倍,如果是首仿药上市,其价格可能也就是原研药的1/5到1/10。所以从这个角度出发,原研药公司还是赚翻天了。
授权仿制药(Authorized Generics:AGs)
在"30个月专利诉讼期的滥用"章节谈到了软猬甲,伯爵一直想不明白一个问题,为啥靖哥哥整天和蓉儿亲亲我我就没事?度娘一下是这么回事"第三十九回:她一向身穿软猬甲,凡靠郭靖身上必惯于使得甲上尖刺不会刺痛郭靖"这么看来,在南宋时期,一位居住于浙江舟山桃花岛附近的药剂师黄药师估计是最早熟练使用仿生学的高手。他创造了软猬甲,可以根据使用者的心情,像刺猬一样竖起或者放下浑身的尖刺,保护使用者。几百年后,美国的原研药企业也学会这这一招,审时度势,熟练收放软猬甲,收起专利尖刺时,就是主动把产品交给仿制药公司去仿制。于是,另一个让FDA很头疼的问题出现了:授权仿制药。
说到这里,需要事先介绍一些概念性的内容。授权仿制药在国内来说不是一个常见的词语,因此可能会比较陌生。同时国内有一些专家学者都特别撰文描述授权仿制药的情况。但是可能由于语言或者具体实际操作的问题,和实际FDA的法规表达的意思还是有偏差。
伯爵特别查了FDA关于AGs的法规,包括直接邮件给FDA关于AGs的问答邮箱(AuthorizedGenerics@fda.hhs.gov),才明白了美国对于授权仿制药的要求和管理。以下为FDA的邮件答复:
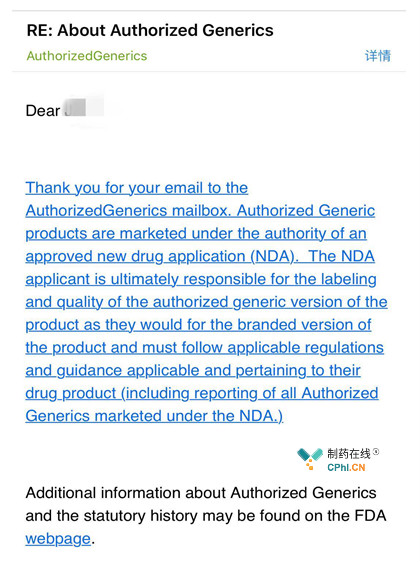
还是老样子,避开所有拗口曲折的学术语言,这次继续用大白话给大家推出一个新的"仿制药"概念。
药品分为原研药和仿制药,而仿制药又分类独立仿制药(Independent Generics:IGs)和授权仿制药(Authorized Generics:AGs),两者的区别就在于前者是仿制药公司自己通过逆向工程开发出来的和原研药疗效等效的药物,并且可以被收录进橙皮书;而后者则是原研药公司授权某个仿制药公司(可能是原研药公司的下属子公司)生产销售该原研药,只是不得使用该产品商品名,而和IGs一样使用通用名而已。FDA对于授权仿制药的说明是"和原研药一样但是不在标签上使用原研药的商品名,授权仿制药被认为是和原研药疗效一致,因为它们就是一样的药品(An authorized generic drug is the same as the brand-name drug but does not use the brand name on the label. An authorized generic is considered to be therapeutically equivalent to its brand name drug because it is the same drug.)"为了解释清楚,伯爵特别列了一下一张表格:
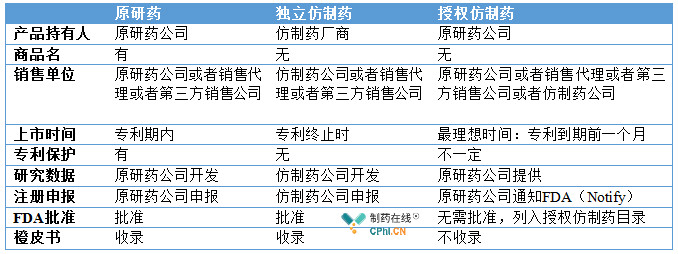
看明白了吧,授权仿制药其实就是换个马甲的原研药。那么为什么会有授权仿制药出现,就是因为首仿药180天的独占期。当首仿药上市后以后,在一开始6个月内,直接可以叫板原研药,并且以更低的价格获得市场,这样给原研药公司造成了极大的困扰。为了应对这种情况,原研药公司回去找其他仿制药企业甚至是原研药公司自己的子公司:"有一桩塌天的富贵欲与君共享。"原研公司将自己的产品授权给这个仿制药公司生产,所用的原料药,辅料,包材,工艺,标准,检测等等,除了设备上有一些差异(设备原理相同),仿制药生产的授权仿制药几乎就是原研药的复制粘贴。由于是完全一致的,因此,只需要原研药公司通知(notify)FDA即可,FDA也会按时制定相应的授权仿制药的目录提供行业参考。这样当某一个首仿药上市时,授权仿制药也几乎在同一时间以更低的价格上市, 由于授权仿制药就是原研药,这样在市场上直接形成两个公司同时生产原研药对首仿药进行夹击。首仿药6个月的市场独占期的利润被大大的压缩。坦率地说,授权仿制药的出现破坏了Hatch-Waxman法案的初衷:鼓励仿制药挑战原研药的专利,同时也有反竞争和垄断的嫌疑。但是,如果从市场经济的角度出发,授权仿制药完全合理合法,没有任何违法违规,暗箱操作的内容,道高一尺,魔高一丈,也就是说的这个吧。
其实从上面三个方面,我们都可以看出,原研药公司都是在挖空心思维持自己在某一个产品的垄断地位,其实这也是在任何行业经济领域都会出现的,扯个题外话,垄断并不是一个非常可怕的事情,如果是市场经济(国字头背景的企业不在讨论范围内)下的行业垄断,很多时候,利弊是需要重新度量的。对于一个企业来说,激烈的竞争基本等于不赚钱,而处于竞争平衡状态时,企业本身也就处于一种不动的状态,当企业处于这种状态,维持一种微妙的平衡时,就会出现大企业病或者组织体系官僚化,人浮于事,这样只需要假以时日,这种"静止"的企业出现一点点错误,很容易会被其他新型公司崛起打败。所以对于制药企业也好,其他行业也罢,在市场经济下,垄断才是最终的目标。失败的公司才竞争,成功的公司只垄断。
生物类似药的水土不服
这个其实不怪Hatch-Waxman法案本身,毕竟颁布的时候是1984年,那时候完全是化药的时代。但是当生物药出现以后,由于大分子构成以及成分远远比小分子要复杂,对于专利的判断也完全是两个概念。另外生物类似药的审评程序和审评标准也一直滞后于生物药这个行业的发展。其实FDA在生物药,特别是生物类似药上的探索落后于它的老朋友也是老对手,大西洋彼岸的EMA。
其实在2000年就有这样的观点:"创新生物制品的专利相继到期,生物仿制品的竞争时机已经成熟,可是现在尚没有生物仿制品的简化申请程序。为批准生物仿制品制订一个体系,要比制定Hatch-Waxman 法案时所遇到的挑战更大"--William Schultz:全美著名投资公司Zuckerman Spaeder LLP合伙人。从生物类似药的立法上面,又一次可以看出美国社会立法的困难和漫长的周期。不过相比之前那些故事,已经好多了。
不仅仅是上面这些,其实在Hatch-Waxman法案实施以后,还有很多仿制药的额问题,比如仿制药和原研药的可替代性,哪怕到现在,美国的仿制药行业已经相当成熟,而Hatch-Waxman法案的出台,推进了仿制药的长足发展,就过去十年而言,仿制药一共为美国政府节省了16700亿美元的开支,即便是这样,目前在美国,有相当一部分的医生和患者都认为那些哪怕是收载于橙皮书,标注为"A"类的仿制药是不能替代原研药的。为此,FDA甚至搜集1996年到-2007年一共2070个生物等效性试验数据作为依据要求美国药物科学和临床药理学专家委员会(Advisory Committee for Pharmaceutical Science and Clinical Pharmacology:ACPS-CP)讲AUC和Cmax的区间缩小为90%-110%(最后被拒绝了)。
不过美元称王的时代,美国人类和社会服务部HHS(相当于我国的卫生监管部门)规定医生开处方必须首先开具仿制药,如果患者有特殊情况只能用原研药,或者患者主动提出要使用原研药,医生才能在处方上著名。
针对上面这些情况,FDA和美国国会还有美国总统都是按照以前的套路,继续出台相应的法规来弥补Hatch-Waxman法案的不足。我想这些过程,不仅仅是对于美国而言,即便是对于追着这个连载的读者来说,也是很熟悉了。这里就不多说了,只是把相应的法规列一下:
2003年出台《更容易获得可支付药品法案》(Greater Access to Affordable Pharmaceutical Act:GAAPA)和《医疗保险处方药和现代化法案》(Medicare Modernization Act,MMA)
主要就是对上面描述的情况从法律层面控制,主要包括了:
1. 目录异议机制:其实就是原研药企业在橙皮书登记专利,当仿制药企业开始仿制并且被原研药企业上诉而处于30个月的审评暂停期,仿制药企业可以反诉原研药企业专利无效,要求橙皮书删除或者修改该专利。这样在专利诉讼上,就把原研药和仿制药公司的权力拉平了。
2. 原研药企业只能提出一次30个月的审评暂停期,之前无休止的提出专利诉讼暂停审评的好事没了。
3. 首仿药企业在ANDA批准后,必须在180天独占期的前75天之内上市,否则取消独占期。
4. 首仿药企业如果签订涉嫌垄断的商业合作协议(根据《反托拉斯法》),将被取消独占期。
5. 原研药公司和仿制药公司签订授权仿制药的协议必须向联邦贸易委员会(Federal Trading Commission:FTC)以及司法部备案。
2009年美国国会通过了《生物药价格竞争及创新法案》( The Biologics Price Competition and Innovation Act,BPCIA)。这个法案其实就是Hatch-Waxman法案生物类似药的翻版,并且明确了生物类似药的定义以及简化上市程序。所以关于生物类似药的界定,FDA在2009年就完成了。
2010年,奥巴马签署《患者保护与平价医疗法案》( Patient Protection and Affordable Care Act,PPACA) 。扩大了医保覆盖人群,市政府在医疗救助及医保中的医疗支出进一步增加。还制定了生物仿制品进入市场的简化申请途径,又称"生物类似药路径" (biosimilars pathway),至此,生物类似药的法规框架基本完成。还记得伯爵在前面文章中的描述吗?要对比差距,看一下相似法规出台的日期就可以。
可以这么说吧2010年出台的PPACA基本填补了Hatch-Waxman法案的漏洞和空白,但是对于授权仿制药,仿制药的可替代性以及专利延长的问题,制药行业,FDA以及美国民众还在彼此不停的博弈斗争。其实不仅仅是美国,包括全世界所有的监管机构都在看FDA,谁让你走得快呢?遇到的问题也更新鲜,这个就是做标杆和领头羊的代价吧。
写到这里,关于FDA的故事也就结束了。在结束之前,想和写之前的文章一样,扯两句闲篇。
第一是关于我国的监管,很多读者说想让我写一下CFDA,现在叫NMPA,我国情况比较特殊,有点过山车的味道,发展速度快,同时也颠簸的厉害,不好预测,比较难写。我只是想,关于我国药品法规的变化以及将来可能遇到的问题,在写其他国家时候,都可以做个参考,多多少少能理解,伯爵就很满足了。所以CFDA(实在不习惯NMPA的缩写)暂时先不考虑了。
第二是关于写这篇FDA的。我一直认为,药品监管,毋庸置疑就是学习FDA。FDA的经历其实就是任何一个国家药品行业发展必然经历的过程。而学习法规又是极端枯燥,这个我也反复在文章中说了,既然这样就把它放到时间轴中去看,把它当作一个个历史故事来看,这样理解起来比较轻松一点。这也就是为什么司马迁的《史记》要比我们现在的历史教科书好看。《史记》就是讲故事,现在的历史教科书则是。。。不说也罢。所有的事物都有自己的历史,通过这些历史,我们也就可以了解以这个事物为中心的所有事件的来龙去脉。这个是伯爵的心得,想要介入一个未知行业,找到这个行业的核心,花时间去研究它的历史,在这个过程中,可以接二连三,链接到其他事件和知识,最后形成自己对这个行业的知识体系。不知道各位有没有玩过红警II,里面有一种坦克叫做光棱坦克,射出一束激光,击中敌方坦克以后然后可以反射到其他坦克上,或者魔兽争霸III中暗夜精灵的女猎手的弹射攻击也有点类似于这个道理。
另外对于法规历史的理解和学习,可以沿用科学技术发展历史的学习方法:也就是"辉格式历史Whiggish history"(和他相对应的是"反辉格历史",可以参见英国君主立宪革命时候的辉格党Whig,后来成为了现在英国的自由党,具体故事这里不展开了)。辉格式历史就是用现在的眼光来评价当时发生的情况,反辉格历史则是完全跳出现在的情况,撇开所有目前的存在,就以当时的情况来评估当时发生的事情及其解决方案和结果。伯爵在看很多历史故事时候,都是用反辉格历史,这样一方面可以更加了解当事人的处境,理解他们的抉择以及相应的后果,另一方面这也是马克思主义唯物史观给我们的要求。(其实马克思主义唯物史观就是反辉格历史,只不过被老马拿过来改了个名字,这个是马克思的惯用伎俩,因为这个也导致了最后恩格斯后悔参与资本论在撰写。)对于药品法规监管历史的学习,由于涉及到很多科学知识,同时法规本身也有传承性,我们可以尝试使用辉格式历史,用现在人的眼光来衡量当时的情况,这样对于我们基于目前的情况,来判断将来的可能,对于我们法规从业人员来说,即使做不到所谓"高瞻远瞩",也可以"避祸趋吉",对于法规制定者来说,那就是帮助整个行业规避掉很多风险,功德无量吧。
啰啰嗦嗦写这么多,也非常感谢各位读者的陪伴,FDA的故事到此结束。好啦,伯爵要调整一下,准备带各位开始下一段异国监管之旅啦!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57