PIC/S是国际药品监查合作计划组织(The Pharmaceutical Inspection Co-operation Scheme)的简称,成立于1995年11月,它是世界上唯一的由GMP检查执法机关组成的国际合作组织。PIC/S成立的宗旨是为了消除药品贸易中的障碍,提高药品获得行政许可的一致性,确保药品质量,促进国际间GMP法规标准的协调及GMP检查质量的一致化。
PIC/S前身为创立于1970年的(Pharmaceutical Inspection Convention,简称PIC);PIC的组织章程不同于PIC/S,PIC是一个以国家为会员单位共同签署成立的正式国际组织,该组织一直运作到欧盟成立的1995年。最终PIC受限于欧盟体制而无法与其它想加入的国家签署协议,因而衍生出另一个非正式、更有弹性的国际合作组织--PIC/S。如今PIC与PICS并行运作(合称PIC/S),持续致力于促进GMP的国际合作及检查标准一致化。
2018年1月1日,新加坡卫生科学局(HSA)的Boon Meow Hoe先生成为PIC/S的第二十三任主席(图1),这也是PIC/S历史上首次由亚洲人担任主席。他的任期为两年(2018-2019年)。PIC/S在全球享有较高声誉,近年来PIC/S影响力不断扩大;另外随着欧美互认协议生效,全球GMP标准一致性趋势越来越明显,PIC/S会员国拥有一致的GMP规范与检查系统,且根据相互之间的协议来决定是否承认对方的检查结果。尽管PIC/S成员国之间对于GMP认证结果不是完全互认的,但是中国制药企业积极学习PIC/S法规和指南,对于更好的熟悉国际法规环境,熟悉国际贸易规则,是非常有裨益的。
加入PIC/S会员的一个基本要求是,其药品监管机构能够采用与PIC/S要求同等的GMP检查体系,其要求和程序能够保证GMP检查体系的执行以及相互间的合作,每一个成员国的检查系统要以PIC/S联合评价项目或同等的项目为基础进行再评价。目前PIC/S有52个会员分属于49个国家或地区,包括阿根廷、澳大利亚、奥地利、比利时、加拿大、中国台北、克罗地亚、塞浦路斯、捷克、丹麦、爱沙尼亚、芬兰、法国、德国、希腊、中国香港特别行政区、匈牙利、冰岛、印度尼西亚、伊朗、爱尔兰、以色列、意大利、日本、韩国、拉脱维亚、列支敦士登、立陶宛、马来西亚、马耳他、墨西哥、荷兰、新西兰、挪威、波兰、葡萄牙、罗马尼亚、新加坡、斯洛伐克、斯洛文尼亚、南非、西班牙、瑞典、瑞士、泰国、土耳其、乌克兰、英国和美国的主要药政机构,其中捷克的S?KL和ISCVBM,法国的ANSM和ANSES以及英国的MHRA和VMD是分别作为两个独立机构加入。(详见图2、表1)。

图1 PIC/S第二十三任主席Boon Meow Hoe先生
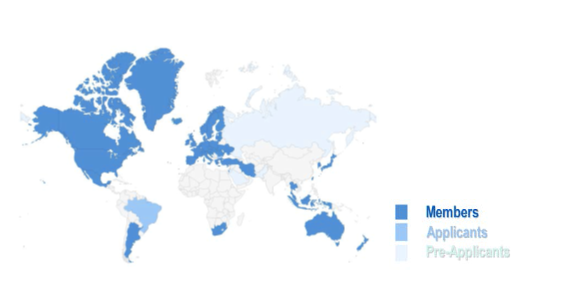
图2 PIC/S 成员机构分布图
表1 PIC/S 成员机构列表
|
No. |
国家/地区 |
参与机构 |
简称 |
加入时间 |
|---|---|---|---|---|
|
1 |
阿根廷 |
国家药物研究所 |
INAME |
2008年1月 |
|
2 |
澳大利亚 |
治疗产品管理局 |
TGA |
1993年1月加入PIC,1995年11月加入PIC/S |
|
3 |
奥地利 |
健康与卫生安全管理局 |
AGES |
1971年5月加入PIC,1999年11月加入PIC/S |
|
4 |
比利时 |
联邦药品和保健品局 |
AFMPS |
1991年9月加入PIC,1997年2月加入PIC/S |
|
5 |
加拿大 |
加拿大卫生部-法规运营和地区分部 |
RORB |
1999年1月 |
|
6 |
中国台北 |
中国台湾食品药品管理局 |
TFDA |
2013年1月 |
|
7 |
克罗地亚 |
医药产品和医疗器械局 |
HALMED |
2016年1月 |
|
8 |
塞浦路斯 |
Pharmaceutical Services |
CyPHS |
2008年7月 |
|
9 |
捷克 |
国家药物管制所 |
SÚKL |
1997年1月 |
|
10 |
捷克 |
兽用生物制品和药物管制所 |
ISCVBM |
2005年7月 |
|
11 |
丹麦 |
医药局 |
DKMA |
1971年5月加入PIC,1995年11月加入PIC/S |
|
12 |
爱沙尼亚 |
国家医药局 |
SAM |
2007年1月 |
|
13 |
芬兰 |
医药局 |
FIMEA |
1971年5月加入PIC,1996年1月加入PIC/S |
|
14 |
法国 |
国家药品和保健品安全局 |
ANSM |
1992年12月加入PIC,1997年2月加入PIC/S |
|
15 |
法国 |
食品、环境和职业健康安全局 |
ANSES |
2009年1月 |
|
16 |
德国 |
联邦卫生部 |
BMG |
1983年9月加入PIC,2000年12月加入PIC/S。 |
|
药品及医疗器械卫生防护中央主管机关 |
ZLG |
|||
|
17 |
希腊 |
国家药物组织 |
EOF |
2002年1月 |
|
18 |
中国香港 |
中国香港药剂业及毒 药管理局 |
PPBHK |
2016年1月 |
|
19 |
匈牙利 |
国家药学与营养研究所 |
NIPN |
1976年8月加入PIC,1995年12月加入PIC/S |
|
20 |
冰岛 |
药品署 |
IMA |
1971年5月加入PIC,1995年11月加入PIC/S |
|
21 |
印度尼西亚 |
药品食品管制署 |
NADFC |
2012年7月 |
|
22 |
伊朗 |
食品药品管理局 |
IFDA |
2018年1月 |
|
23 |
爱尔兰 |
保健品管理局 |
HPRA |
1977年12月加入PIC,1996年2月加入PIC/S |
|
24 |
以色列 |
制药标准化及控制研究所 |
ISCP |
2009年1月 |
|
25 |
意大利 |
药品管理局 |
AIFA |
1990年8月加入PIC,2000年2月加入PIC/S |
|
26 |
日本 |
厚生劳动省 |
MHLW |
2014年7月 |
|
药品和医疗器械评价中心 |
PMDA |
|||
|
Japanese Prefectures |
- |
|||
|
27 |
韩国 |
食品药品安全管理局 |
MFDS |
2014年7月 |
|
28 |
拉脱维亚 |
国家药物署 |
ZVA |
2004年1月 |
|
29 |
列支敦士登 |
卫生保健办公室 |
AG |
1971年5月加入PIC,1995年11月加入PIC/S |
|
30 |
立陶宛 |
国家药品监督管理局 |
SMCA |
2009年7月 |
|
31 |
马来西亚 |
国家药品监督管理局 |
NPRA |
2002年1月 |
|
32 |
马耳他 |
药品管理局 |
MAM |
2008年1月 |
|
33 |
墨西哥 |
联邦卫生风险保护委员会 |
COFEPRIS |
2018年1月 |
|
34 |
荷兰 |
Health and Youth Care Inspectorate |
IGJ |
1995年11月 |
|
35 |
新西兰 |
药品和医疗器械安全局 |
Medsafe |
2013年1月 |
|
36 |
挪威 |
医药局 |
NOMA |
1971年5月加入PIC,1995年11月加入PIC/S |
|
37 |
波兰 |
Chief Pharmaceutical Inspectorate |
CPI |
2006年1月 |
|
38 |
葡萄牙 |
国家药品和保健品管理局 |
INFARMED IP |
1971年5月加入PIC,1999年1月加入PIC/S |
|
39 |
罗马尼亚 |
国家药品和医疗器械局 |
NAMMD |
1995年11月 |
|
40 |
新加坡 |
卫生科学局 |
HSA |
2000年1月 |
|
41 |
斯洛伐克共和国 |
国家药物管制所 |
SIDC |
1997年1月 |
|
42 |
斯洛文尼亚 |
药品和医疗器械局 |
JAZMP |
2007年7月 |
|
43 |
南非 |
保健品管理局 |
SAHPRA |
2007年7月 |
|
44 |
西班牙 |
药品和医疗器械局 |
AEMPS |
1998年1月 |
|
45 |
瑞典 |
药品署 |
MPA |
1971年5月加入PIC,1996年2月加入PIC/S |
|
46 |
瑞士 |
医药管理局 |
Swissmedic |
1971年5月加入PIC,1996年2月加入PIC/S |
|
47 |
泰国 |
食品药品管理局 |
Thai FDA |
2016年8月 |
|
48 |
土耳其 |
药品和医疗器械局 |
TMMDA |
2018年1月 |
|
49 |
乌克兰 |
国家药品监督管理局 |
SMDC |
2011年1月 |
|
50 |
英国 |
药品和保健产品监管署 |
MHRA |
1971年5月加入PIC,1999年6月加入PIC/S |
|
51 |
英国 |
兽药局 |
VMD |
2014年1月 |
|
52 |
美国 |
食品药品监督管理局 |
US FDA |
2011年1月 |
PIC/S设有委员会、执行委员会和秘书处三个职能机构。自2014年以来,PIC/S在以下领域设立了七个小组委员会,分别为培训(SCT)、专家小组(SCEC)、战略发展(SCSD)、合规(SCC)、GM(D)P协调(SCH)、预算、风险与审计(SCB)和沟通(SC COM)(详见图3)。
GMP检查员培训是PIC/S的一项重要活动,PIC/S的宗旨之一就是促进国际GMP法规标准的协调及GMP检查质量的一致化;通过PIC/S GMP指南协调GMP的要求并不足以确保对GMP的统一解释和应用,因此对GMP检查员的培训是实现这一目标的必要工具。最近,PIC/S还向活跃于其他领域的检查员开放了培训计划,如GDP、GCP和GVP等等。2018年,PIC/S举办的系列培训如下表:
|
日期 |
地占 |
活动 |
组织方 |
|
2018年9月11-13日 |
中国台北 |
质量风险管理(QRM)专家小组会议及高级培训 |
中国台北 / TFDA |
|
2018年9月26-28日 |
美国芝加哥 |
PIC/S 2018“产品生命周期风险管理”研讨会" |
US FDA |
|
2018年10月16-18日 |
西班牙马德里 |
PIC/S GDP专家小组 |
西班牙/ AEMPS |
|
2018年10月23-25日 |
波兰华沙 |
PIC/S人用血液、组织、细胞和ATMPs专家小组 |
波兰 / CPI |
|
2018年11月26-30日 |
日本栃木 |
PMDA-ATC GMP检查研讨会 |
日本/ PMDA (支持方PIC/S) |
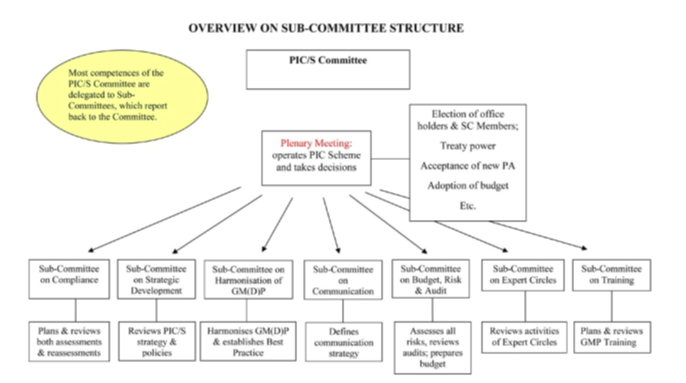
图3 PIC/S组织机构图
GMP和GDP的协调是PIC/S的核心,采用共同标准的主要原因是:确保药品质量、推动药品获得行政许可的一致性、推动检查的一致性和统一性、推动医药产品贸易壁垒的消除,这些也正是PIC/S成立的宗旨。SCH包括七个工作组,分别是:GMP附件1 无菌生产工作组、GMP附件2修订工作组、数据完整性工作组、GMP缺陷分类协调工作组、共用设施交叉污染控制工作组、PIC/S血液指南文件修订工作组、PI 006验证修订工作组。
SCH的主要职责之一是协调与欧盟的GM(D)P指导文件,特别是PIC/S GMP指南和附件,并将欧盟修订的文件转换为PIC/S自身所用。2018年SCH协调转换的文件包括:修订了PIC/S GMP指南第3章(设施和设备)、第5章(生产)和第8章(投诉和产品召回),该指南于2018年7月1日生效;将欧盟GMP附件13(临床试验用药品)的修订版改为PIC/S版本,于2019年提交征求意见;讨论了将欧盟附件16(QP人员认证和批放行)修改为PIC/S版本的建议。另外PIC/S专家也参与了EMA起草小组对以下章节以及EU-PIC/S GMP指南附件的修订:第1章(制药质量体系)、第4章(文件)和附件11(计算机化系统)、附件1(无菌制造)、附件17(实时放行测试,原来的参数放行)、附件21(进口药品到欧盟所应承担的GMP责任)。
PIC/S专家小组由PIC/S委员会设立,以促进GMP特定领域(如血液、计算机化系统、API、质量风险管理、共用设施交叉污染、GDP、GCP、GVP等)的检查员之间的讨论和信息交流。专家小组会议定期制定指导、建议等草案,并在各自的专业领域提供培训。
2017年6月,中国CFDA加入ICH后,中国药品监管在研发和注册领域的国际化道路上迈出了历史性一步,药品走出国门的步伐将进一步加快。但是在药品生产监管领域,中国的监管体系还未能与其他欧美主流国家实现互认。PIC/S上任主席Paul Hargreaves曾在2016年于华盛顿召开的PDA/FDA联合年会上提到"中国多年以来曾表示其加入PIC/S组织的兴趣,并且PIC/S也曾会见了CFDA……"。另外,PIC/S 2019年工作计划中也明确提出:将与非成员主管当局建立 (或保持) 密切联系, 这些机构表示有兴趣加入PIC/S, 特别是中国/NMPA和印度;另外PIC/S将持续加强与中国/NMPA的合作。
下表列出了中国药政机构和PIC/S组织相关的关键事件:
|
时间 |
典型事件 |
|
2016 |
PIC/S时任主席Paul Hargreaves在PDA/FDA联合年会上提到“中国多年以来曾表示其加入PIC/S组织的兴趣,并且PIC/S也曾会见了CFDA……”。 |
|
2017.04 |
国家药监局邀请PIC/S组织观摩,评估18个省级药监机构对于企业的GMP检查情况。 |
|
2017.08 |
国家局领导在第十一届药典委员会成立会议上面提到:经国务院批准,我们加入了国际人用药品注册技术协调会(ICH),下一步还要争取加入国际药品认证合作组织(PIC/S)。 |
|
2019.01 |
PIC/S年度工作计划提到:中国药监局(NMPA)有兴趣加入PIC/S。 |
笔者通过对上述信息进行汇总和分析,综合研判:中国药监局(NMPA)加入PIC/S还需要较长的时间。原因其一是中国国内的各省监管水平差距较大,除了传统制药大省、长三角省份和珠三角省份具有较强的法规监管能力,其他省份实施PIC/S 的GMP监管体系有现实困难。原因其二是政治考量,毕竟中国台湾和中国香港已经是PIC/S成员,如何处理相互关系,是需要中国药监局(NMPA)慎重考虑的。
参考资料:
1- PIC/S ANNUAL REPORT 2018
2- PIC/S官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57