近日,CDE公示新一批临床默示许可名单,恒瑞1类新药SHR-1802获批临床,适应症为标准治疗失败的晚期恶性肿瘤。据业内人士推测,SHR-1802应该就是LAG-3单抗,一些业内人士认为LAG-3单抗有望成为继PD-1/L1之后,免疫治疗领域另一个重要的抗肿瘤药物,目前全球尚无相同靶点的单抗药物上市。

(资料来源:CDE)
LAG-3
LAG-3(淋巴细胞激活基因-3, 又名CD223)是一种免疫检查点受体蛋白,主要表达在活化的T细胞、NK细胞、B细胞和浆细胞树突细胞。LAG3可通过和MHC II分子的结合,下调T细胞的活性。同时,LAG3也可增强调节性T细胞(Treg)的抑制活性。利用治疗性抗体抑制LAG3,可解除对T细胞的抑制,增强机体免疫应答。
法国免疫学家FrédéricTriebel于1990年首次发现LAG-3免疫控制机制,他的研究小组首次证明,可溶性的LAG-3分子通过MHC II信号传导激活抗原呈递细胞,促使抗原特异性T细胞反应。然而,关于MHC II分子是否单独调控LAG-3的抑制功能还存在争议。据之前的研究表明,LAG-3发挥免疫抑制功能可能是由其他未知配体介导的。
去年12月,耶鲁大学陈列平教授团队在Cell上发表了题为"Fibrinogen-like Protein 1Is a Major Immune Inhibitory Ligand of LAG-3"的论文,证明了纤维介素蛋白1(Fibrinogen-likeprotein 1,FGL1)是LAG-3的一个重要的功能性配体,并揭示了该LAG-3-FGL1通路是独立于B7-H1-PD-1通路的另一条肿瘤免疫逃逸通路,阻断这条通路能和抗PD-1治疗起到协同作用。
LAG-3-FGL1通路
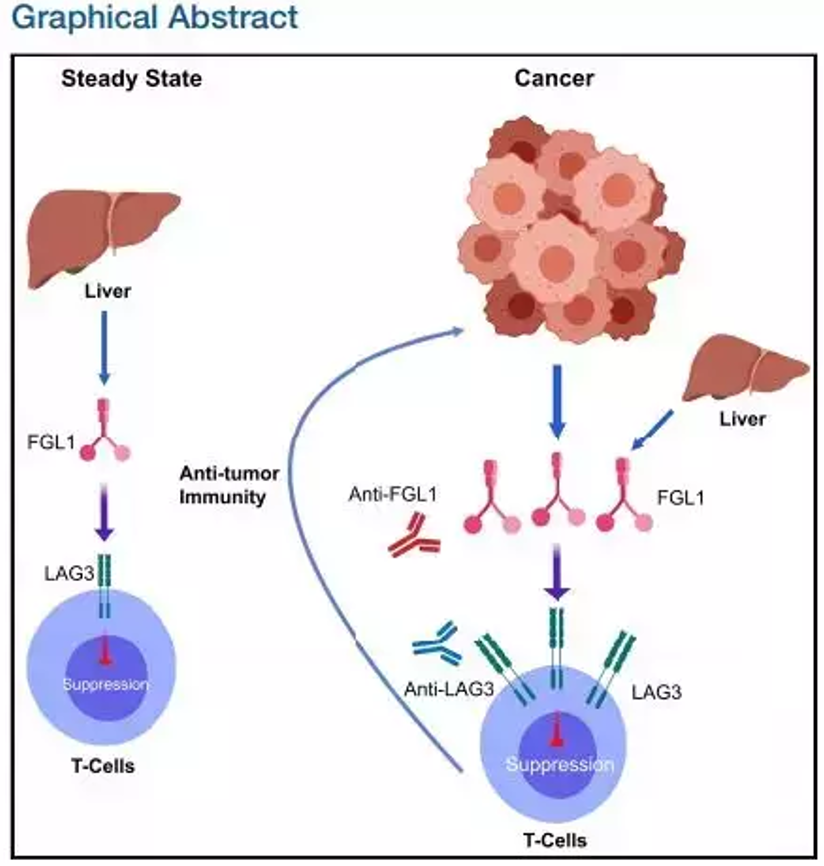
(资料来源:Cell)
国内外LAG-3单抗研发如火如荼
全球虽然尚无相同靶点的单抗产品上市,但百时美施贵宝、诺华、默沙东等国外制药巨头以及恒瑞、信达、再鼎医药、药明等国内制药巨头正在开展LAG-3单抗单药使用以及联合用药的临床研究。
截至目前,全球共有将近30款LAG-3单抗产品在研,国内外多个制药巨头均在布局。
先看国外方面,目前已有多种LAG-3单抗进入临床试验,包括百时美施贵宝的Relatlimab、诺华的LAG525/IMP701、默沙东的MK-4280、再生元的REGN3767、GSK旗下Tesaro的TSR-033以及F-Star的FS118等等。其中,进展最快的应该是百时美施贵宝的Relatlimab,与O药联用治疗晚期黑色素瘤的临床试验已进入Ⅲ期,此外还有二十多个临床试验处于临床Ⅱ期,适应症包括胃癌、三阴乳腺癌等多项适应症。再生元REGN3767单药或联合PD-1单抗治疗晚期癌症也已入临床。
再看国内方面,目前已有多家LAG-3单抗获批临床,包括亿腾景昂药业的Eftilagimod Alfa、信达生物的IBI110以及维立志博的LBL-007、恒瑞的SHR-1802等。
国内LAG-3单抗研发进展
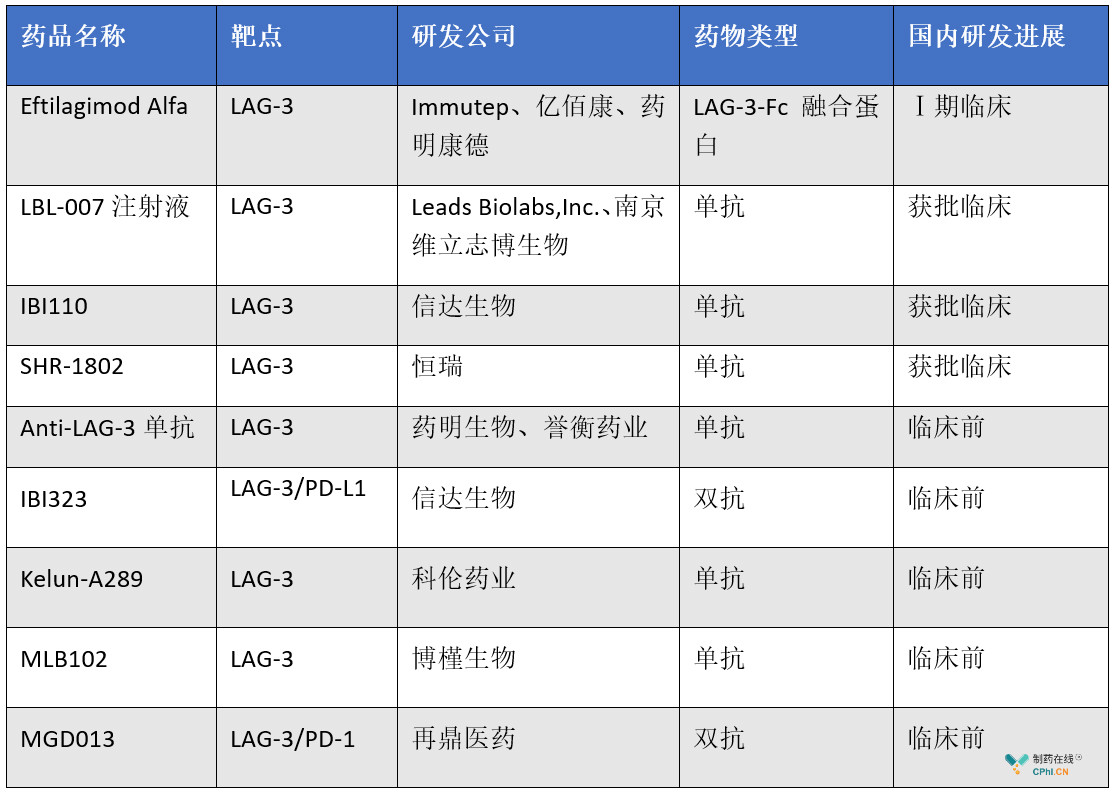
(根据公开资料整理,若有不全处,欢迎留言补充)
目前,Eftilagimod Alfa进展较快。Eftilagimod Alpha(代号:IMP321/EOC202)为Immutep公司开发的LAG-3-Fc融合蛋白,属于抗肿瘤1类新药,亿腾医药拥有该药在中国大陆、中国香港、中国澳门及中国台湾开发和销售的专属权。2018年11月14日,亿腾医药宣布,其正在复旦大学附属肿瘤医院进行I期临床试验的Eftilagimod Alfa已完成首例患者第1周期给药,这也是该创新药首次面向中国人群进行的临床试验,主要目的是评估EOC202皮下注射联合紫杉醇一线化疗用于中国转移性乳腺癌患者。
2019年4月26日,信达生物抗LAG-3单抗IBI110临床试验申请获受理(受理号CXSL1900040),7月12日,获临床默示许可,适应症为血液肿瘤和实体瘤。
2019年5月27日,南京维立志博生物宣布,其自主研发的第一个产品-抗LAG-3全人源单抗LBL-007的进口临床申请获CDE受理(受理号:JXSL1900052)。8月13日,获默示许可,适应症为标准治疗失败或缺乏标准治疗方案,经组织学或细胞学确诊的晚期实体瘤。
此前,业内人士一直推测恒瑞的SHR1601为LAG-3单抗,但笔者并未查询到相关信息,反而是SHR-1802于2019年8月正式递交临床试验申请,应该就是LAG-3单抗。
在新药研发领域,时间就是金钱,恒瑞由于其专业的研发背景,雄厚的资金实力,未来会不会成为LAG-3单抗研发的第一梯队,笔者认为这是大概率事件。
作者简介:菜菜,上海交通大学药学硕士,曾工作于科学技术情报研究所,现为药监系统从业人员,擅长解读行业法规、药研动态等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57