多年以来,中国行进在从制药大国向制药强国迈进的征途中,我国作为原料药生产大国,化学原料药发展迅猛,原料药产业在我国制药领域保持着举足轻重的地位,多个品种产量位居世界第一,是全球最大的原料药生产国和出口国之一。但是随着环保治理的加强、成本、产能的问题以及行业竞争日趋激烈、国际监管措施日趋严格,很多原料药企业遭遇洗牌,国内的很多原料药企业开始从以"API 为主"向"制剂为主"转型。另一方面,纵观我国制剂行业的发展,起点较低,基础用药覆盖面高,创新制剂技术及人才相对匮乏,但经过多年的发展,制剂行业也整体呈现出稳步上升的发展态势。近年来,随着制药行业全球化竞争的加剧以及仿制药市场的蓬勃发展,我国的制剂企业在国际市场上努力开拓和耕耘,涌现出一批优秀的制剂企业,如华海、人福、东阳光、复星、石药、齐鲁、恒瑞等(详情可阅读"致敬开拓者的背影-中国制药企业在美申报ANDA情况全扫描),在制剂出口及国际化道路上做出了卓越的贡献,但是我们必须清醒的认识到我国药物研发创新水平与医药强国之间仍存在着差距,我们虽然拿下了不少的ANDA文号,但是FDA的NDA批文长期以来一直是空白。
2019年11月15日,百济神州自主研发的布鲁顿氏酪氨酸激酶(BTK)抑制剂泽布替尼获FDA加速批准,用于治疗既往接受过至少一项疗法的成年套细胞淋巴瘤患者,成为迄今为止第一款完全由中国企业自主研发、在FDA获准上市的抗癌新药,实现了中国原研新药出海"零的突破"。
根据FDA 505法案,FDA的注册审评审批中,新药申请(NDA)包括505(b)(1)和505(b)(2)。505(b)(1),是传统的新药申请(New Drug Application, NDA)途径,即独立NDA(stand-alone NDA),该途径用于其活性成分(Active Pharmaceutical Ingredient, API)尚未被批准的新药。这种类型的申请申报验难度最高,需要提交广泛完整的安全性和有效性研究报告,包括临床和非临床研究,用以证明该药品的安全性和其适应症的效力。由于需要大量研究和数据,505(b)(1) NDA提交可能需要很多年才能完成,并且需要投入大量资源才能获得批准。
505(b)(2)途径主要是为了支持批准已上市药物的新的适应症、给药途径或缓释剂型,提交的数据可以有少部分依赖于此药品的分子结构和其相关产品有关的安全性(Safety)和有效性(Effectiveness)的结果。
NDA申请是一个漫长艰苦的过程,评审极其严格,从新药立项到NDA审批至少需要十年的时间(详见图1)。
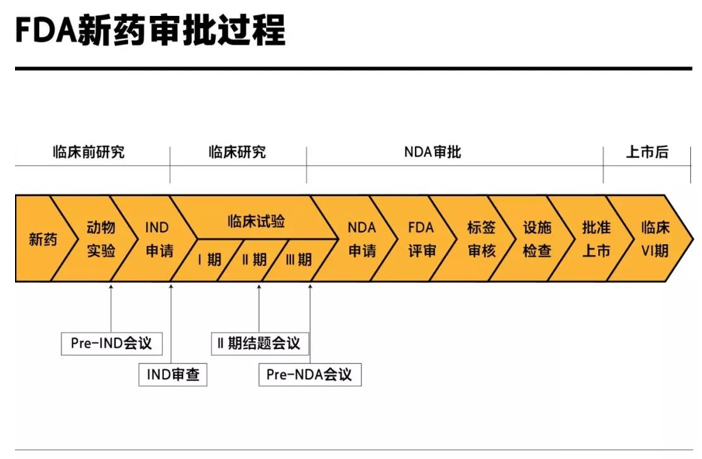
图1 FDA新药审批过程(图片来源:时代数据)
百济神州是一家同时在美国纳斯达克以及中国香港上市的新药研发公司,专注于分析靶向药和免疫肿瘤疗法的研发,拥有丰富的药品研发管线,泽布替尼从2012年7月最初立项开发,2014年在澳大利亚正式进入临床阶段,2019年获FDA授予的"突破性疗法认定"和优先审评资格,再到2019年11月的正式获批上市,历时7年。
泽布替尼的获批是中国新药创新史上的突破,也标志着我国的现代制药进入到新阶段。下面我们重点盘点一下还在NDA征途中的中国制药企业:
天士力
天士力是一家把中药与国际标准接轨,将中药推向国际市场的中国企业。1997年天士力复方丹参滴丸开始在美国申请新药临床研究(IND)。与此同时天士力借鉴欧洲植物药材种植管理规范,建立起符合国际药材原料规范化种植(GAP)标准的药源种植基地,并首 创了现代中药提取质量管理规范(GEP)标准,并向cGEP标准扩展,力推其成为国家行业标准乃至国际标准,而且按照这个标准建成了国内水平最高、规模最大的数字化中药提取基地。2006年,天士力再度向美国FDA申报并获得一期、二期临床试验批件,2010年8月,复方丹参滴丸一举通过了FDA关键的二期临床试验。2012年天士力正式启动了复方丹参滴丸FDA三期认证工作。2016年,复方丹参滴丸在世界多国、多临床中心顺利完成了申报美国FDA的大样本、随机双盲、双对照三期试验。经过20多年的努力,天士力完成了科技创新、产品质量提升、产业链完善等全面升级,天士力复方丹参滴丸已经顺利进入新药申报准备阶段,这二十多年来,尽管困难重重、一波三折,尽管有不少质疑的声音,但天士力以国际化带动现代中药创新研发和标准提升的不懈努力,必将为中药国际临床试验和注册、审批标准及法规体系建设,为中药走向世界提供重要借鉴。
绿叶制药
绿叶制药集团是一家致力于创新药物研发、生产和销售的国际化制药公司,公司从2000年开始介入创新制剂领域,并将微球制剂作为10余年来"主攻"目标之一,成功建立了长效缓控释技术平台,包括了从微球制剂的基础研究到中试等各个环节,在国际上颇具竞争力。绿叶制药征战FDA的产品是利培酮微球注射剂(LY03004),是国家"重大新药创制"科技重大专项之一,在美国申报新药选择的是505b(2)路径,如果药品合适,运用好505(b)(2) 途径进行申请可以到比505(b)(1) 监管途径需要更少资源,使用较短的药物开发计划。
2013年初,利培酮微球注射剂(LY03004)正式在美国开展一期临床研究,后经过与FDA的多次讨论沟通,2015年9月FDA正式确认利培酮缓释微球注射剂Rykindo(LY03004)(LY03004)不需再进行任何临床试验,可在美提交新药申请(NDA)。2019年3月28日,绿叶制药向美国FDA正式提交Rykindo?(注射用利培酮缓释微球,LY03004)的NDA新药上市申请,2019年5月,FDA完成立卷审查,正式受理利培酮缓释微球注射剂的NDA新药申请, 2019年11月绿叶制药集团收到美国FDA正式检查报告,显示集团位于中国烟台的长效制剂生产基地以零483成功通过上市批准前检查(PAI)。至此,绿叶制药集团自主研发的创新制剂注射用利培酮缓释微球Rykindo(LY03004)距离在美获批上市再近一步。
石药集团
石药集团是一家集创新药物研发、生产和销售为一体的国家级创新型企业。多年前从以原料药为主开始转型,走上了创新药和新型制剂研发之路,集团坚持走国际化创新路线,目前有7个创新药在美国开展临床试验,丁苯酞软胶囊已经处于II期临床阶段,丁苯酞、抗体药物偶联物ADC(DP303c)、人源化间隙连接蛋白43单克隆抗体(ALMB-0166)等5个产品均获得美国FDA颁发孤儿药的资格认定并展开新药临床试验,盐酸****片等19个品种获ANDA批件并在美国实现销售(详见图2、3、4)。2019年3月5日,石药集团成功就用于治疗高血压的马来酸左旋氨氯地平片向美国FDA提交新药上市申请。据石药集团称,此为中国医药企业首 次向美国FDA提交新药上市申请。该药品在美国的临床开发是以中国的疗效数据和增强的安全性资料为根据,此次于美国提交的马来酸左旋氨氯地平片规格为1.25毫克、2.5毫克及5.0毫克。在这之前,石药集团于2018年10月与FDA进行了新药上市申请前会议,并在2018年12月完成了关键性临床研究。
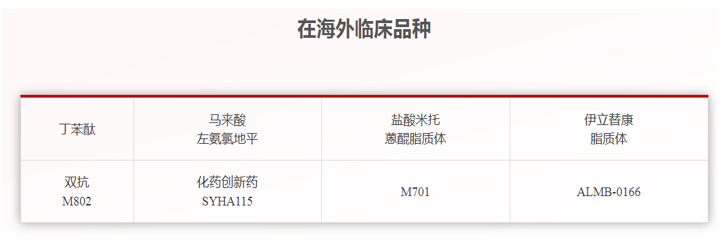
图2 石药集团在海外临床品种(来源:石药集团官网)

图3 石药集团在美孤儿药品种(来源:石药集团官网)
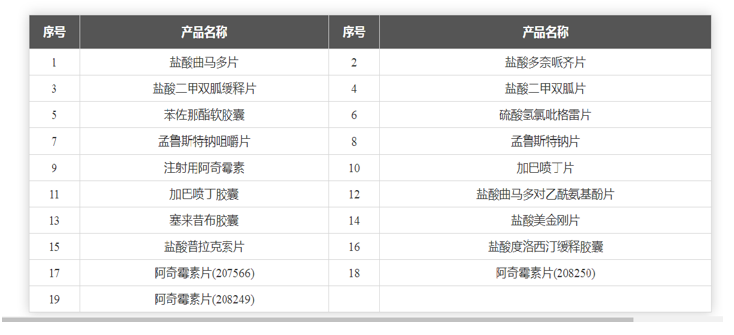
图4 石药集团ANDA品种(来源:石药集团官网)
补充说明:近期,石药集团(01093)发布公告,美国食品药品监督管理局(FDA)已批准CONJUPRI(马来酸左旋氨氯地平)片剂用于治疗高血压的新药上市申请(NDA)。公告称,FDA的批准使集团可于美国推广销售CONJUPRI,亦有助其于世界其他地区的推广销售。而石药集团的马来酸左旋氨氯地平是完全依据中国临床数据来支持申报的。应该说,这也是一个突破。
一万年太久,只争朝夕。在赴美申报NDA征途上,这些先行者的能力和付出,是值得制药同仁给与尊敬的。他们对于中国制药行业在国际地位的争取,对于国内研发局面的改善和带动,都是具有明显贡献的。我们也相信,再过十年,制药行业在国际创新领域,会取得更显著成绩。
参考资料:
1.天士力医药官网
2.绿叶制药集团官网
3.石药集团官网
4.FDA官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57