
在这段特殊的日子里,方舱医院的“清流哥”意外火了,在嘈杂人声中,他躺在病床上,静静阅读着厚厚一本《政治秩序的起源:从前人类时代到法国大革命》。有人说看到这一幕,焦虑的心顿时安定下来,称他是疫情中的清流、定海针、压舱石。
书籍与阅读就是这么神奇,翻开的那一刻,不知不觉中抚慰了我们的心灵,安定了我们的心神。在居家隔离的日子里,我们无形中有了更多的时间翻阅书卷,与先贤对话,与同行神交,在阅读中沉淀自我思考,不亦乐乎。
春风三月,CPhI制药在线现诚挚推出“制药悦读”栏目,每月至少向广大制药同仁推荐一本关于制药的好书,切磋读后感,通过深度洞察与分析回馈读者朋友。
制药悦读第一期,将由CPhI制药在线特约撰稿人,在制药行业摸爬滚打工作近30年的“老法师”zhulikou431先生分享他近期阅读的一本制药好书——《中国医药研发40年大数据》。
悦读福利:
1、转发本文至朋友圈,将截图发送消息给CPhI制药在线(公众号ID:cphi_cn)小编,3月13日小编将抽取3位读者赠送一本《欧美法规和ICH下的原料药工艺开发及变更》培训会纸质版课件,百页详细资料一手掌握。公布中奖名单后请在公众号联系小编领取。
2、点击本文微信版(https://mp.weixin.qq.com/s/5gF3WxoXC8RwT_lYaWdS_w)文末“在看”按钮,截止到3月13日中午12点,“在看”人数若超过100,我们将在下期抽奖赠送《中国医药研发40年大数据》。
第一部分:引子
高考结束时,我的高考志愿项目本都是医学项目。没有想到,由于高考失利,本想悬壶济世的我,却一脚踏入杏林的旁支-药学工作领域。万千人间事,弹指一瞬间;如果加上本科读书期间的岁月,掐指一算,我已经在制药行业工作26年了。虽然在过去的26年时间里,我也一直在努力工作;但是由于天生愚钝,目前还是一介凡夫俗子。下面我的文字只是自己阅读书籍的粗浅感受,只愿自己过去26年工作的一些感悟可以有益于各位方家和朋友。
四顾环宇,中国制药行业经过多年砥砺前行,应该说,在世界制药领域已有一席之地。然若细较行业运行质量,还有诸多待完善之处。现代中国制药的发轫,应该在新中国成立之前就开始了。若按照新中国成立之年限算起,也有70年峥嵘岁月。然后若论制药行业规范、快速和密集发展的开端,还是应该从改革开放为起点,迄今正好40年整!
青春不惑,岁月正隆!值中国制药行业蓬勃发展时代,中国健康传媒集团和中国医药科技出版社联合出版的《中国医药研发40年大数据》的出版,既是对过去制药人不懈奋斗的总结,本身也是中国制药行业历史构成的一页。
第二部分:全书概况


《中国医药研发40年大数据》由陆涛和李天泉担任主编,汇聚制药行业内16位从业者共同编写而成。该书在2019年5月份出版,内容共43.6万字,16开本。《中国医药研发40年大数据》一书内容分为7篇,分别是开放篇、注册监管篇、化学药篇、中药篇、生物制品篇、药物临床试验机构及临床试验的发展变迁、中国药企研发实力分析等。本书题眼在医药研发四字,因此书籍核心内容集中于研发、申报和注册等业务领域;而众所周知,药品在各个国家都属于被严格监管的特殊商品,因此说,本书行文重点也以介绍法规、政策和指南发展变化趋势,以及行业对法规政策应对为主要内容。
中国是人口大国,政府对人民群众健康所承担的责任以及社会的持续关注,都要求制药行业规范发展、科学发展和被智慧监管。而制药行业这一特点,更应该被制药行业从业人员所深刻体会。从药品生命周期看,应该包括药品研发、申报、注册、审批、上市、流通、上市后变更直到退市等环节。从整体角度看,虽然本书主要内容是介绍过去40年药品研发和注册业务,但是我想如果从事药品生命周期后段业务(例如上市后运营、流通、上市后变更等环节)人员去阅读此书,也是会有所裨益的。
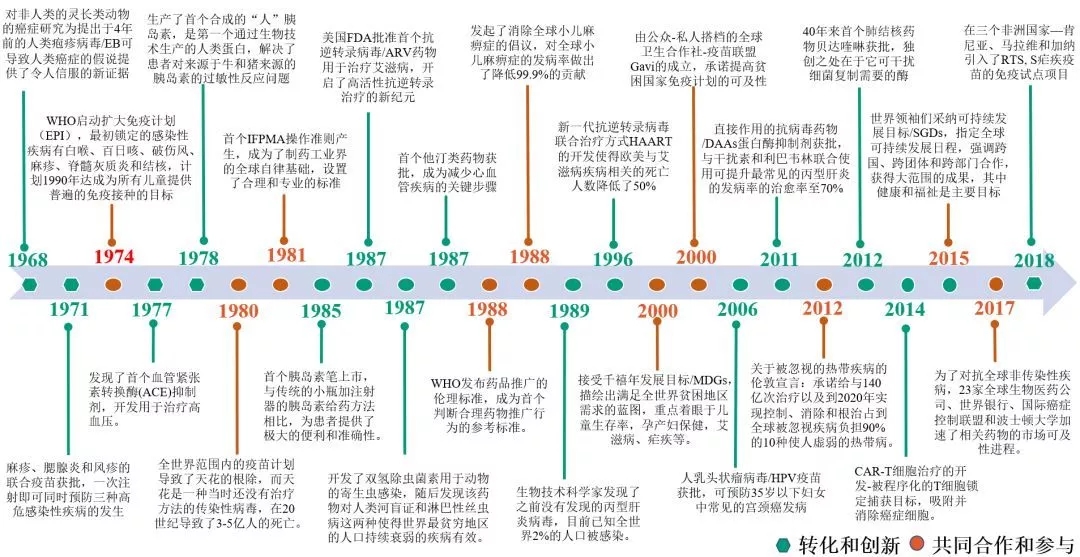
全球医药工业研发体系50年大事件
第三部分:重点章节
3.1-他山之石,可以攻玉
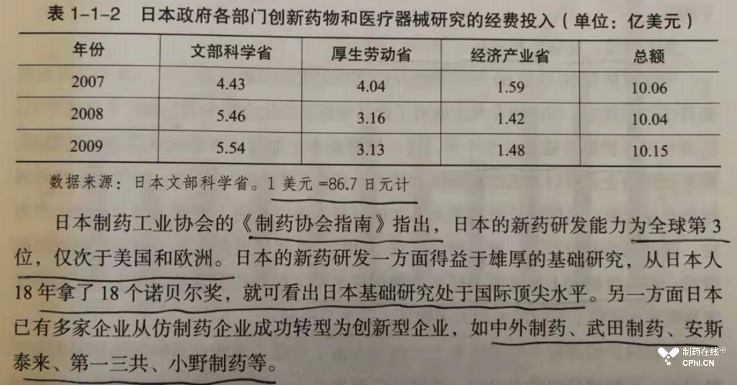
本书第一篇是开放篇,包括四个章节,分别是:第一章深度全球化的医药产业、第二章改革开放之引进来、第三章改革开放之走出去。在其中第一章中的第二节介绍了日本创新药的经验,在第三节介绍了印度仿制药的丰富经验。这些中国近邻的工作经验对于近日的中国制药企业还是具有积极借鉴意义的。
下面这张截图展示了日本曾经在医药领域的投入和日本领先企业。
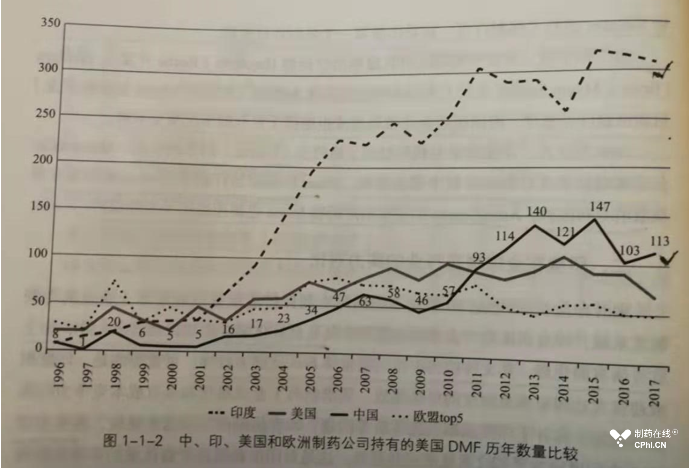
在介绍印度制药工业时,本书提到了印度制药工业从无到有,从弱到强的发展历程;以及目前印度排名靠前的领先企业和相关经验。下面这张截图体现了在DMF申报方面的中印差距:
在改革开放引进来的章节,介绍了首先进入中国医药市场的国外企业-老五家:天津大冢、上海施贵宝、无锡华瑞、西安杨森和苏州胶囊的发展历程。而在走出去的中国企业中,则重点介绍了石药集团和华海药业。
3.2-中国法规体系的昨日与今天
本书第二篇的主题是注册监管篇,包括三个章节:第一章改革开放以来医药行业发展概况、第二章中国药品研发的环境变化、第三章中国药品注册制度的变革。鉴于药品属于被特殊监管的商品,药品行业发展受到政策影响较大,因此建议读者重点阅读第三章。
中国药品监管法规体系的建设,用古语描述就是:筚路蓝缕,以启山林。下面截图展示了建国初期的制度草创阶段的情况:

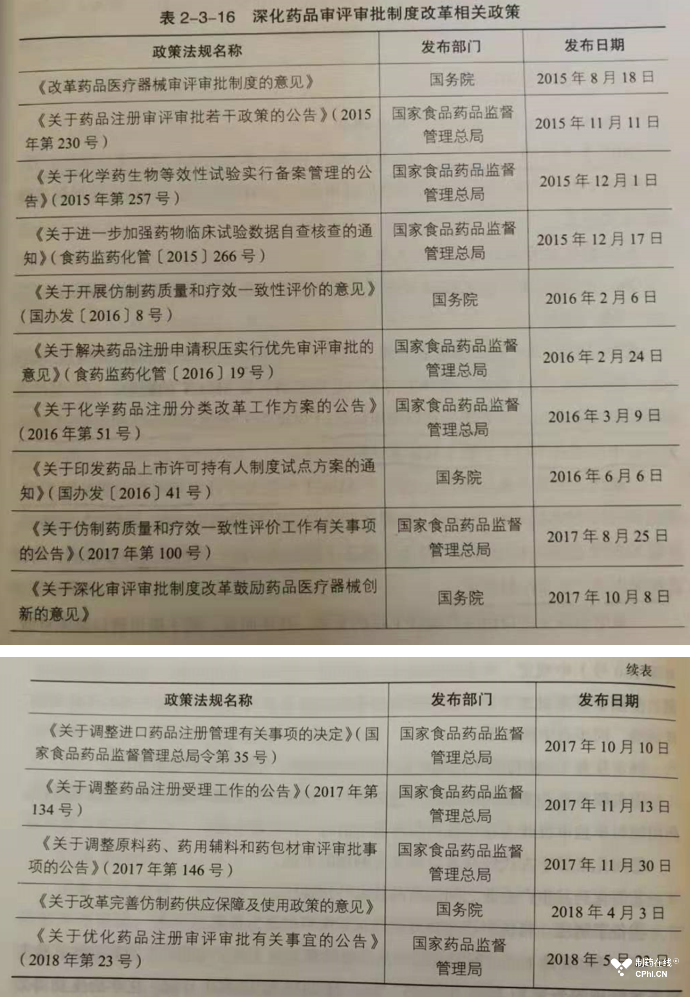
根据本书介绍,中国药政监管体系发展分为如下阶段:1949-1977年阶段、1978-1998年阶段、1998-2015年阶段、2015-2018年深化改革阶段(此阶段还在继续推进前行)。药品监管法规和政策浩繁,下面截图展示了深化改革阶段出台的部分政策:
3.3-中国制药工业的主体-化学创新药和化学仿制药
本书第三篇是化学药篇,包括四个章节:第一章改革开发40年化学药药品发展概况、第二章化学药新药、第三章化学仿制药、第四章仿制药质量和疗效一致性评价。化学药品作为中国制药行业的关键和主导性分支,不管是企业数量、从业人员数量、产值和产品数量等居于前茅。推荐读者重点阅读第二章化学药新药和第三章化学仿制药。
药品注册审批制度的建立,关键点是审批对象的准确界定。本书介绍了中国药政历史上新药定义和仿制药定义的变化。下面截图展示了新药定义的演变:
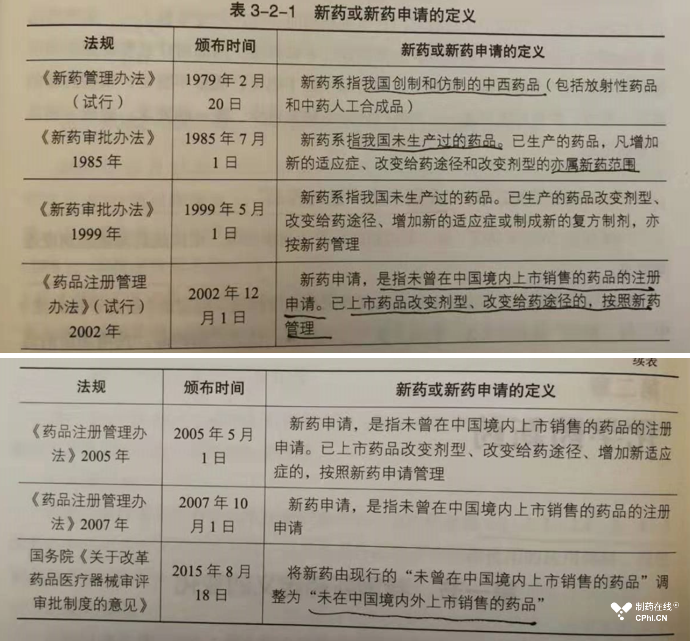
下面截图展示了中国仿制药定义演变过程:
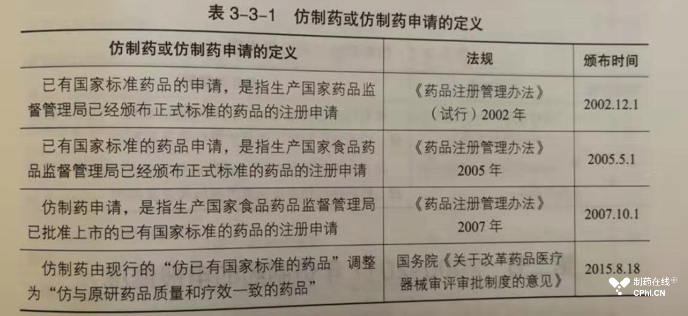
3.4-传承和发展-中药反思和前瞻
本书第四篇是中药篇,包括如下章节:第一章中药发展概况、第二章中药1-5类新药、第三章中药复方制剂、第四章中药改变给药途径与改变剂型药物、第五章中药仿制药、第六章中药注射剂、第七章天然药物。中药是中国先民在漫长历史过程中发明和创造的财富,一直得到中国政府的大力支持和民众的信赖。但是也必须提到,随着改革开放以来化学药品与生物制药的快速发展,中药受到了很大的挤压。这里面既有政策的影响,也有中药行业自身实力薄弱、基础研发得不到足够重视的原因。由于中药的情况比较复杂,本书在中药篇设置了7个章节来介绍,文字内容也达到146页。
本篇推荐重点推荐阅读章节是:第二章中药1-5类新药、第四章中药改变给药途径与改变剂型药物、第五章中药仿制药。由于这本书收集信息时间截止到2018年,因此2019年剧烈的法规变化没有体现出来。2019年12月10日发布的《药品注册管理办法》(第三修订稿)提出的中药同方同名药概念,应该说对于中药仿制药是一个利好消息。下面截图展示了中药仿制药曾经的热闹和今日的惨淡:
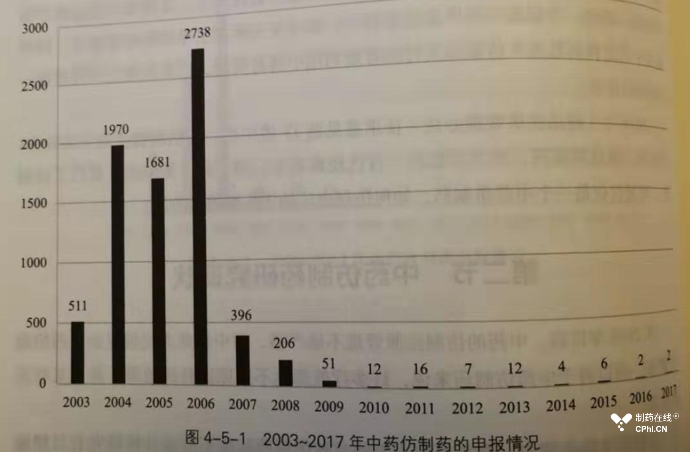
3.5-方兴未艾,蓬勃发展的生物制药
生物制药虽然在中国市场发展较晚,但是由于生物制品具有靶向性好、治疗效果明显,在一些危重急症方面疗效突出而被行业所持续关注。本书第五篇是生物制品篇,内容包括:第一章生物制品的概况、第二章治疗用生物制品、第三章预防用生物制品。以生物制品目前在中国制药行业的位置和投资关注度,本书关于生物制品章节的投入资源是不足的,估计和撰写人员对于相关产品知识储备有关。
推荐阅读本篇的第二章治疗用生物制品和第三章预防用生物制品。对于生物制药快速发展的领域,本书也设置适当篇幅给予介绍,例如Car-T技术。下面截图展示了细胞治疗技术的发展历程:
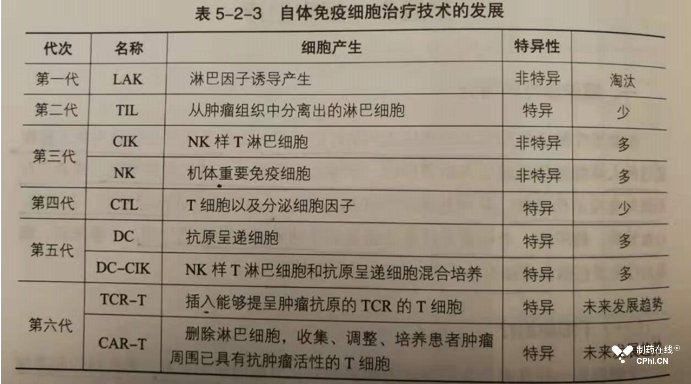
3.6-临床试验-药品上市的关键步骤和核心价值判断标尺
自2015年启动的中国药政体系改革的一个显著特点,就是强调药品上市的金标准-临床价值。为此,不管是中国国家药监局,还是相关申办方,还是CRO机构都投入资源和力量促进这一目标的实现,并持续纠偏。典型事件就是百济神州泽布替尼依靠国内临床数据获得FDA批准,还有石药集团的玄宁依靠真实世界证据来获得FDA批准。
本书第六篇是药物临床试验机构及临床试验的发展变迁,内容包括第一章中国药物临床试验法律法规体系的构建与完善、第二章中国药物临床试验机构及临床试验的发展、第三章中国药物临床试验管理运营、中国药物临床试验的未来发展趋势与建议。推荐读者重点阅读第二章和第三章。由于过去很长一段时间,中国药政机构对于新药临床试验实施"严进宽出"的政策,导致同一药品在中美市场上市时间差距较大,导致被民众持续批评。随着2015年启动药政体系改革,对于境外临床数据的接受,这种局面得到了一定程度的改善。下面截图展示了相关案例:
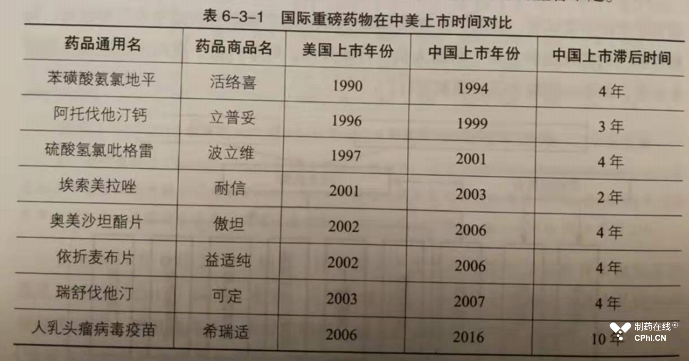
不过,就我个人工作经验看,中国目前对于临床试验质量的核查不应该放松,还应该继续加强。
3.7-百舸争流中国药企研发实力纵览
制药企业无疑是制药工业发展的核心力量和持续推动力来源,也是满足民众用药需求的社会主体力量。本书第七篇介绍了中国领先的研发企业情况。第七篇包括第一章中国药品研发企业实力分析和第二章中国药品研发地区实力分析。应该从第一章和第二章的内容综合可以看出,长三角企业和珠三角企业在中国药品研发领域居于翘楚地位。当然了,针对不同的细分领域,可能会有所不同。例如中药研发领域,北方企业则占据排行榜前列位置。下面截图展示了各省企业在研发领域的实力排名:
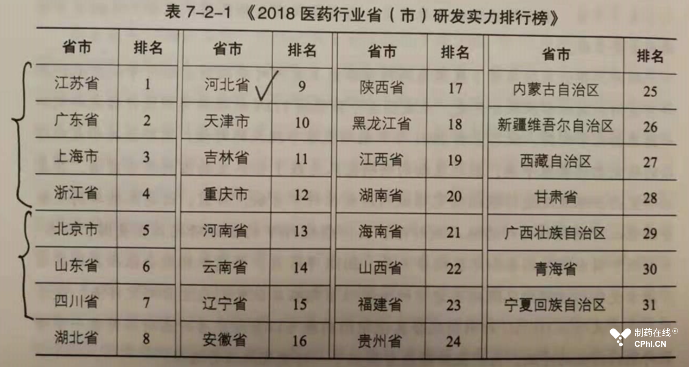
看到上面这样的实力排名,让从业人员不得不感慨:吴楚之脆弱,足以抗衡于中原!
第四部分:我的点滴感悟
4.1-制药从业人员应该培养复合能力
正如前面提到的,从药品生命周期看,应该包括药品研发、申报、注册、审批、上市、流通、上市后变更直到退市等环节。因此说,即使一位制药从业人员在某个具体岗位工作,去学习和了解医药行业其他环节和其他相关领域法规、指南和行业信息,对于本职工作的促进也是很有帮助的。
4.2-制药从业人员应该具有国际视野
从目前行业情况看,中国制药行业的化学药品和生物制药行业都和世界制药行业密切联系;而对于中国本土传承和发展的中药细分行业,也需要对国际相关研究领域保持适当关注度。随着改革开放,中国更多制药行业开始积极参与国际市场合作与竞争,对国际制药行业信息进行了解,更显得愈加重要;这种重要性在中国药监局加入ICH组织以后,已经发展到一个新的历史高度。
4.3-制药从业人员应该培养行业洞察力和预判能力
一个优秀的制药行业从业者,不管从事综合管理、还是从事技术研发和销售等岗位,都需要对行业信息进行充分搜集和深度分析,并逐步形成持续强化的洞察力和判断力。没有这种意识和能力的培养,不管对于个人,还是对于所工作的企业,都是不利的。
4.4-终身学习-制药人的必修课
制药行业不仅是资金密集型行业,也是知识密集型行业。对于其中的从业者,不仅要求有较高的学历,还需要有自觉的持续学习能力和愿望。在过去5年,不管是国内市场还是国际市场,在法规和技术方面都发生了巨大变化。如果从业者不重视持续学习能力,被行业所抛弃几乎是不可避免的。诚如魔都上海俗语---时代抛弃你,连再见都不会说。
第五部分:白璧微瑕
5.1-国际横向对比数据偏少
正如前面所提到的,尽管本书在第一篇的第一章介绍了欧美发达国家的医药工业,也重点介绍了近邻日本和印度的制药工业情况;但是总体而言,本书在多个章节中对于中国制药工业和国际领先对手的对比分析还是偏少的。例如在生物制品章节,和欧美相关情况对比偏少;而在中药方面,介绍欧盟植物药注册情况,以及对日韩植物药介绍信息也略显不足。
5.2-对GLP知识介绍太少
现代药品研发工作是多学科、多门类知识的综合性活动。在药品研发初期,尤其是创新药研发早期阶段,动物试验的重要性是不可忽视的。但是本书有一个明显不足---对于药品研发中动物试验内容和GLP相关法规进展情况,介绍很少,甚至没有专门的章节。
5.3-药品现场核查内容介绍偏少
药品研发不仅是科学性和法规性工作,还需要确保数据真实、可靠。而在中国过去40年医药研发领域进行的多次大规模现场核查,都说明中国制药行业在研发方面不仅科学性需要继续提高,数据合规性也需要继续给予重视。而且随着中国国家药监局启动对境外研发项目的核查,从公告内容看,境外研发数据作假情况有时也是触目惊心的。本书在这个方面,对这个关键环节介绍内容还有不足。
5.4-对40年制药行业发展的挫折反思偏少
应该说,大量介绍成绩是人见人爱的,而深刻反思过去的教训则是需要痛苦面对陈旧伤疤的。本书尽管在多个章节也提到了过去中国制药行业发生的种种反面案例和不堪,但是在案例情况的全面性和分析深刻性方面,还是存在不足的。
5.4-研发企业实力对比章节深度不够
本书第七篇主要介绍中国研发企业实力情况和对比分析。虽然从文字描述和表格看,也算完成了任务;但是从内容广度和深度看,存在明显不足。第七篇页数总计28页,和其他篇章比较明显不足。中国制药行业的发展,是监管方和被监管方共同努力的结果;而在当前社会现实情况下,制药企业的持续努力和不懈奋斗更显可贵。可能限于这部分内容作者本是行业中人,或者限于各研发企业内部架构、资源分配、管理制度、项目推进细节都是商业机密,总之,这个结尾章节类似于《长安十二时辰》的结尾。
结语
云卷云舒江河在,不信青史尽成灰!中国制药行业从建国初期的筚路蓝缕,以启山林的状态发轫,经历二十几年的蹉跎岁月,终于在改革开放的大潮中,瞄准欧美领先对手,持续努力、不懈奋斗,终于发展成可以为中国14亿民众提供充分医药产品、并积极拓展国际市场的国民经济重要组成部分。在过往的悠悠岁月中,中国制药行业有失败和挫折,有迷惘和苦闷,更有不畏强手,力争上游的豪情和毅力!
正如本文开始提到的,《中国医药研发40年大数据》的出版,既是对过去制药人不懈奋斗的总结,本身也是中国制药行业历史构成的一页。因此我推荐制药行业朋友阅读此书,以回望过去风雨,展望未来前途,扩展视野,坚定信心,以自身的发展来促进行业的发展,以自身的提高来促进行业提高。所述凡识,是以为荐!
参考文献:
1-《中国医药研发40年大数据》
2-NMPA数据库
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。
赠书福利:
1、将本文转发至朋友圈或制药群,分享给更多制药同仁阅读。
2、关注CPhI制药在线微信公众号,将转发截图在CPhI制药在线公众号后台发送给小编。

3、3月13日,CPhI制药在线公众号将在后台发送截图的粉丝中随机抽取3位,各赠送一本《欧美法规和ICH下的原料药工艺开发及变更》培训会纸质版课件,百页详细资料一手掌握。获奖名单同日在本公众号公布。

4、点击本文微信版(https://mp.weixin.qq.com/s/5gF3WxoXC8RwT_lYaWdS_w)文末右下角“在看”按钮,若截止3月13日中午12点,“在看”人数超过100,“制药悦读”第二期将抽奖赠送《中国医药研发40年大数据》
点击下图进行CPhI & P-MEC China 2020观众预登记抽奖,奖品多多!




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57