在2020年六一儿童节的前一天,上海复宏汉霖对外宣布,其在欧盟申报的生物类似药HLX02(注射用曲妥珠单抗)得到EMA下属的CHMP的积极评价,审评意见提到"HLX02与参照药赫赛汀(曲妥珠单抗)高度相似,研究数据支持HLX02在质量、安全性与疗效等方面与赫赛汀均无显著差异。"如果随后欧盟委员会(European Commission)批准了复宏汉霖的上市申请,这将是第一个成功进军欧盟市场的中国制造的生物制品,而复宏汉霖也必将书写进军欧盟市场的新篇章。
第一部分:中国生物类似药法规发展和复宏汉霖的开拓
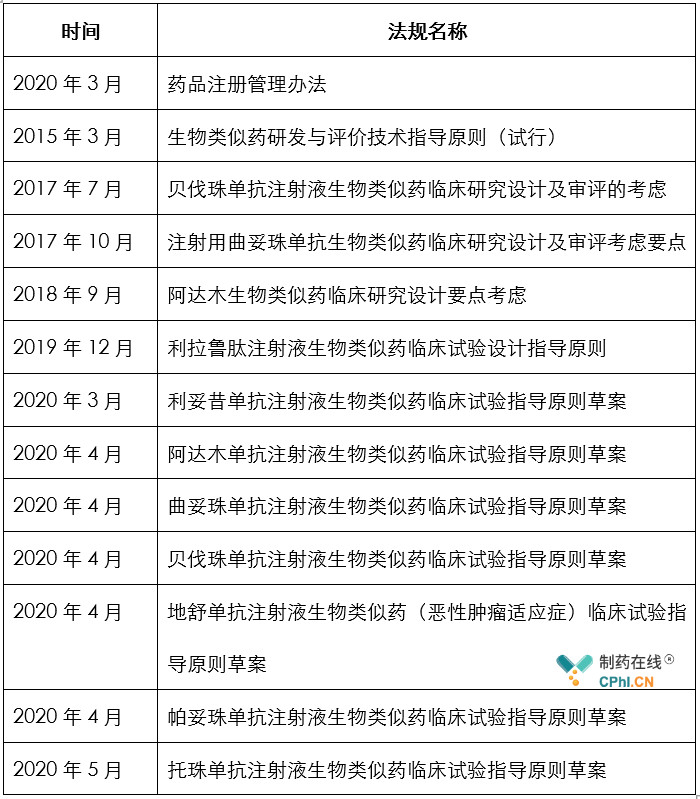
和欧美官方相比而言,中国国家药监局(NMPA)在2015年才发布第一部涉及生物类似药的法规;这项工作比欧盟大概晚10年时间,比美国FDA晚6年时间。
根据笔者汇总,截止目前,中国药政官方发布的和生物类似药相关法规如下表:
上海复宏汉霖作为上海复星集团下属生物制药公司,主营业务是各类生物制品的研发和生产。在2009年,复宏汉霖开始启动利妥昔单抗(原研公司产品的商品名是美罗华)研发工作。经过十年奋斗,先后投入3.3亿元的研发资金,终于在2019年2月获得国家药监局批准。这也是中国第一个本土企业申报成功的生物类似药,商品名确定为汉利康,适应症是用于 CD20阳性非霍奇金淋巴瘤的治疗。
经过检索,确认目前上海复宏汉霖在国内上市产品是利妥昔单抗注射液,包括两个规格。
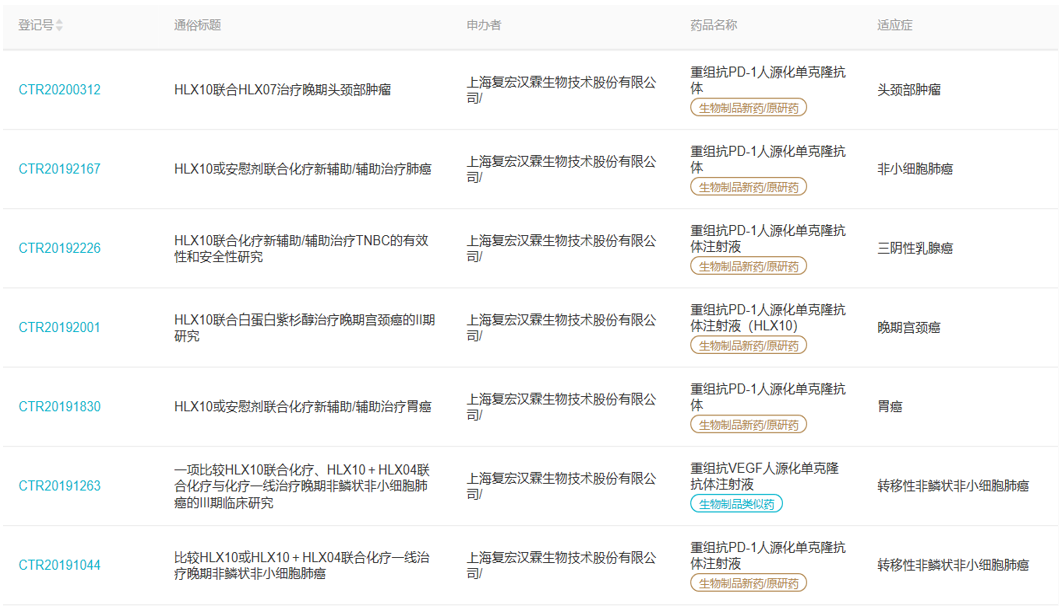
目前复宏汉霖已经形成完善的生物制品研发平台体系。根据丁香园insight数据库检索,目前复宏汉霖在开展27项临床试验,下面是部分项目信息截图:
第二部分:复宏汉霖产业化基地进展和欧盟GMP认证突破
在2019年2月,复宏汉霖获得第一个生物类似药汉利康批准时,其在上海宜山路漕河泾附近的生产基地能力已显不足。为了更好的支持研发项目,并积极满足市场需求,复宏汉霖在上海复星医药集团和松江区政府支持下,在上海松江区投资设立生物药产业化基地,用于复宏汉霖单克隆抗体的创新研发和产业化。复宏汉霖生物药产业化基地将按照国际GMP标准设计、建设,并将充分应用国际新技术建设低碳、节能、环保的现代化智能生物医药基地。此前,复宏汉霖已按照GMP标准在上海漕河泾经济开发区建成采用国际先进一次性反应器等设备为核心技术的抗体药物中试及产业化生产基地,此次将在松江区落地的生物药产业化基地主要为满足复宏汉霖产品陆续上市后的产能需求,有利于公司产品研发的高效推进,也有利于复星医药结合现有产业资源和上海市松江区产业培育发展环境,建成现代化智能生物医药基地,进一步增强复星医药生物药领域的研发能力及国际化水平。
为了加快向欧盟市场进军,上海复宏汉霖以宜山路漕河泾基地为主体,向欧盟提出GMP认证申请。经过全体员工的努力奋斗,在2019年12月顺利通过了欧盟GMP检查。这也是中国第一家获得欧盟GMP认证的生物制品企业。可以说,顺利通过欧盟GMP认证,不仅展示了复宏汉霖扎实的质量体系,也为复宏汉霖产品在欧盟的注册提供了强力支持。下面是复宏汉霖的原液和制剂GMP证书。


第三部分:复宏汉霖在欧盟注册进展
上海复宏汉霖在欧盟进行拓展是和合作伙伴Accord Healthcare Limited一起进行的。复宏汉霖在欧盟申报的曲妥珠单抗,是中国首个进行国际多中心3期临床研究的生物类似药,也是中国首个在欧盟报产的中国生产单抗生物类似药。
为了顺利开拓欧盟市场,2018年,复宏汉霖与英国Accord公司达成商务合作协议,授予Accord在欧洲地区(包括英国、法国、德国和意大利等在内的53个国家)、中东及北非地区(17个国家)和部分独联体国家的HLX02独家商业化权利。
HLX02(曲妥珠单抗)是由复宏汉霖按照欧盟和中国生物类似药相关指导自主开发和生产的生物类似药,其欧盟MAA由复宏汉霖与合作伙伴Accord共同推动,未来HLX02在欧洲的商业化将由Accord负责。根据EMA审评流程,CHMP的积极审评意见将被递交至欧盟委员会(European Commission, EC),EC将参考CHMP的审评意见并在未来2-3个月做出最终决定。若最终获得批准,HLX02即可在全部欧盟成员国以及欧洲经济区国家挪威、冰岛和列支敦士登上市销售,成为进入欧洲市场的第一个中国本土生产的单抗生物类似药;上海复宏汉霖所付出的努力不仅为自己开拓欧洲市场奠定了坚实基础,也必将为中国生物制药行业在欧盟的拓展书写新的篇章。
说明:本文不构成价值判断和投资建议。
参考文献
1- EMA官网信息
2- NMPA官网信息
3- CDE官网信息
4- 丁香园insight数据库信息
5- 复宏汉霖官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57