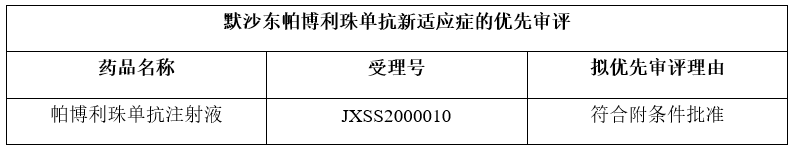
近日,国家药监局药品审评中心(CDE)最新公示,K药即默沙东旗下帕博利珠单抗的一项新药上市申请符合附条件批准,拟纳入优先审评。
资料来源:CDE
值得一提的是,根据CDE官网,这是帕博利珠单抗在中国提交的第6项上市申请。
晚期肝细胞癌一线治疗
从帕博利珠单抗中国临床试验进展来看,此次拟纳入优先审评的新适应症为一线治疗晚期肝细胞癌(HCC)。
在此之前,帕博利珠单抗联合口服多受体酪氨酸激酶抑制剂仑伐替尼用于一线治疗晚期肝细胞癌(HCC)的联合疗法在Ⅰb期临床试验KEYNOTE-524/study116的中获得了积极结果:对于未接受系统治疗的不可切除HCC患者达到具有临床意义的总缓解率,组合疗法的ORR为36%,中位DOR为12.6个月。
另外,在中国临床肿瘤学会(CSCO)近日发布的2020年版《原发性肝癌诊疗指南》中,帕博利珠单抗与仑伐替尼的联合疗法获得了一线治疗晚期肝细胞癌(HCC)Ⅲ级专家推荐。
国内市场已获批的5项适应症
帕博利珠单抗已经在全球多个多家和地区获批,截至目前,这款药物已经在全球获批了24个适应症,包括了美国获批的两项"不限癌种"适应症。
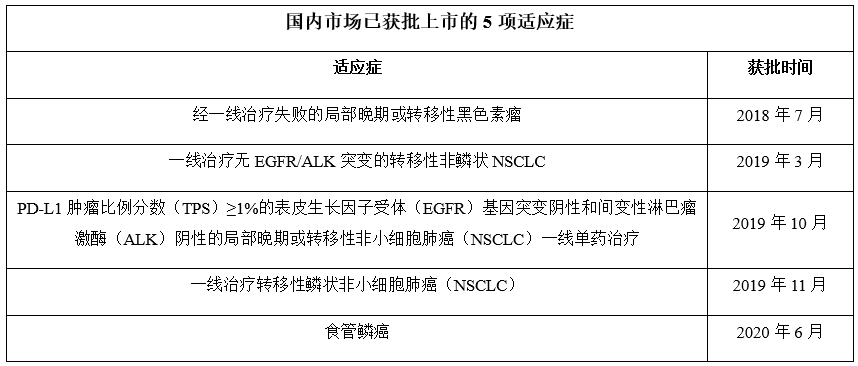
在中国市场,帕博利珠单抗已获批了5个适应症:按照获批的时间依次为经一线治疗失败的局部晚期或转移性黑色素瘤、一线治疗无EGFR/ALK突变的转移性非鳞状NSCLC、PD-L1肿瘤比例分数(TPS)≥1%的表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性的局部晚期或转移性非小细胞肺癌(NSCLC)一线单药治疗、一线治疗转移性鳞状非小细胞肺癌(NSCLC)及食管鳞癌。
数据来源:公开资料整理
国内的31项临床试验 27项为Ⅲ期临床
根据药物临床试验登记与信息公示平台,围绕帕博利珠单抗,默沙东在中国共登记开展了31项临床试验,27项为Ⅲ期临床,涉及到的适应症包括了胃癌、肝细胞癌、乳腺癌、胃食管交界处腺癌、宫颈癌、前列腺癌、尿路上皮癌、胆管癌、子宫内膜癌等。
可以预期的是,默沙东未来将在中国市场推动帕博利珠单抗更多新适应症的上市进程。
百亿美元量级 未来可期
在全球畅销药的销售排行榜中,2019年首次有3款药物的年度销售额突破百亿美元,除了阿达木单抗之外,帕博利珠单抗和来那度胺首次进入百亿美元行列。
值得注意的是,帕博利珠单抗以上市5年破百亿美元的速度创造了新纪录,已经是全球第二大畅销药,这一成绩的取得在很大程度上是基于良好的治疗效果及广泛的适应症,市场规模得以迅速扩大。
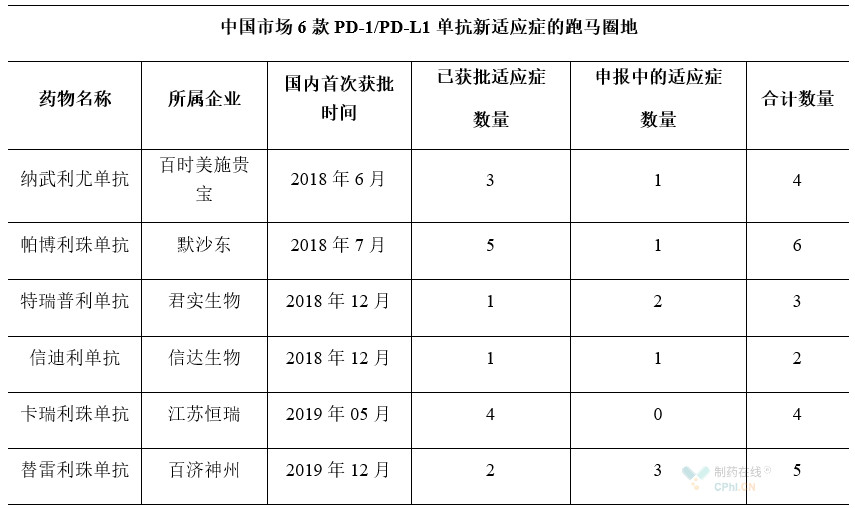
截至目前,国内已经有8个PD-1/PD-L1单抗获批上市,包括了4款国产PD-1单抗、2款进口PD-1单抗及2款进口PD-L1单抗。从目前的竞争格局来看,中国市场的6款产品具备了先发优势,已进入了第一梯队。
数据来源:公开资料整理
基于同样的逻辑,目前,已进入第一梯队的6款产品均积极布局了国市场的新适应症,旨在赢得国内市场的未来。
根据Frost & Sullivan曾做出的预测,2030年全球的PD-1/PD-L1单抗药物市场规模可达789亿美元,中国市场的规模预计为131亿美元。作为百亿美元量级的重磅药物,帕博利珠单抗在中国市场的竞争格局优势显著,随着更多新适应症的获批,国内市场将成为这款单抗药物的业绩新亮点。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57