8月14日,CDE发布了《新型冠状病毒预防用**研发技术指导原则(试行)》等5个文件,其中《新型冠状病毒预防用**临床评价指导原则(试行)》从临床需求、安全性、有效性、上市评价、境外临床试验数据等各方面给出了新冠**上市的评价标准。新冠**研发指导原则的发布,旨在保证质量、加速推动新冠**上市。
《原则》给出的候选新冠**标准
适用人群
候选新冠**最好能适用于所有年龄段,包括孕妇及哺乳期女性;至少应适用于成年人,包括老年人。
安全性
不良反应较轻、持续时间较短,无严重不良反应或发生率极低。新冠**不应具有ADE风险。
保护效力
以安慰剂为对照的试验,目标人群的保护效力最好能达到70%以上(点估计值),至少应达到50%(点估计值),95%置信区间下限不低于30%。**最好能提供1年及以上的保护,至少提供6个月的保护。
临床试验过程中可变更免疫程序
允许在确定最适宜的免疫程序和剂量前进入Ⅲ期临床试验,可以考虑在Ⅲ期临床试验过程中变更免疫程序(如增加接种剂次),或在上市后再行优化。为了获得长期保护性,各种免疫程序及接种途径均可接受。接种剂次少、接种间隔短即可快速发挥保护作用的**以及给药途径便捷的**,在疫情暴发期间更具有优势。
附条件上市申请
如在Ⅲ期临床试验期中分析结果显示具有明确可接受的保护效力,但由于临床试验并未结束,结果并不稳健,尚未达到可提前终止试验的标准时,经获益风险评估,可将数据用于申请附条件批准上市,同时继续完成临床试验。
支持境内上市的数据依据
用于**评价的数据无论来源于境内还是境外临床试验,经评估数据来源、数据质量和试验结果均符合要求的,可考虑作为支持**在境内上市的重要依据。
国际同行已发布的新冠**标准
在CDE发布上述5个指导文件之前,世卫组织、美国FDA已相继发布了新冠**研发或评价的标准指南。
4月9日,WHO发布了新冠**的目标产品特性( Target Product Profiles for COVID-19Vaccines),列出了WHO对新冠病毒**产品的多项指标希望达到和最低限度应该达到的标准。
7月1日,美国FDA发布新冠预防**的开发和批准指南(Development and Licensure of Vaccines to PreventCOVID-19),对新冠**开发和批准过程中的多个问题分享了FDA当下的思考。
此次,CDE发布我国新冠**一系列指导文件,将推动我国新冠**研发评价体系或标准接轨国际,更好地为人类抗击新冠肺炎贡献力量。
不同技术路线的新冠**各有优缺点
从目前全球新冠**开发的技术路线来看,核酸和重组**占据了半壁江山,各种技术路线都有各自的优缺点:病毒灭活**工艺最简单,但是免疫效价相对也低;腺病毒**耐受性良好,但是一部分人体内已有腺病毒抗体,会导致**失效;mRNA**制作速度最快,但是容易降解。
全球已公布临床试验数据的7款新冠**
截至目前,全球7款新冠**已相继披露了临床数据。现有临床试验数据显示,在研新冠**表现出体液免疫和细胞免疫,并且数据支持开展Ⅱ期/Ⅲ期临床。
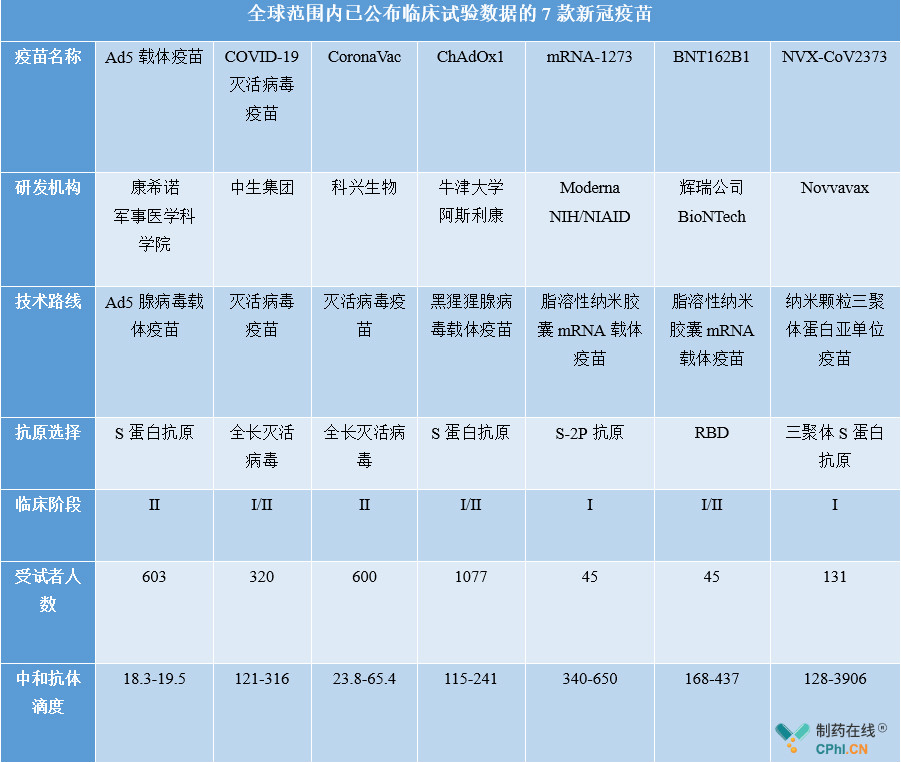
资料来源:公开资料整理
目前,全球已上市的传染病**基本都是通过诱导中和抗体实现机体保护,中和抗体滴度可以在在一定程度上反映出保护力的强弱。仅从上表中的数据来看,中生集团COVID-19灭活病毒**是目前国内开发的诱导血清中和抗体活性最好的**,也不亚于辉瑞、阿斯利康和Moderna的**;同时这款**的不良反应较轻,Ⅲ期临床试验已经展开。
需要注意的是,目前的新冠**并无全球统一标准,各种技术路线及不同单位研发的新冠**均采用各自的标准体系,不同机构使用不同的中和试验方法、单位和统计方法都不同;即使相同的方法,使用毒株不同结果也会有很大差异,因此,绝对值的横向比较指导意义不大。
另外,目前尚未建立起抗体滴度与临床保护率之间的关系以及体液免疫、细胞免疫对于预防新冠病毒侵袭的机制,因此无论哪种技术路线均无法通过现有临床数据判定**是否有效,关于新冠**的更多答案可能只有从Ⅲ期临床试验的结果来揭晓。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57