10 月 9 日,CDE官方网站显示,突破性治疗公示,拟将康方生物 AK104注射液纳入突破性疗法程序,适应症为既往含铂治疗期间或治疗后疾病进展的复发或转移性宫颈鳞癌(含腺鳞癌),公示截止日期为2020年10月15日。
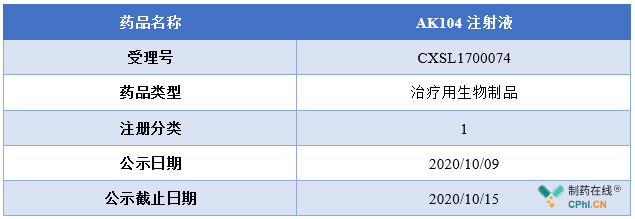
资料来源:CDE
全球首个进入临床的PD-1/CTLA-4 双特异抗体
作为一种人源化免疫球蛋白G1双特异性抗体的抗肿瘤免疫治疗药物,AK104注射液是康方生物利用其 Tetrabody 双抗平台、自主研发的首款双抗产品,也是全球首个进入临床试验阶段的PD-1/CTLA-4 双特异抗体。
AK104 可同时靶向程序性细胞死亡蛋白 1(PD-1)及细胞**T淋巴细胞相关蛋白 4(CTLA-4)两个免疫检查点分子,进行高亲和力的结合,旨在实现与肿瘤浸润淋巴细胞,而不是正常外周组织淋巴细胞的优先结合,靶向双靶点可增强抗PD-1/L1 和抗-CTLA-4 抗体联合应用的效果并减少治疗相关**。
疗效与安全性表现出色
在2020年美国癌症研究协会年会AACR 2020中,相关方公布了AK104联合mXELOX一线治疗晚期胃癌或胃食管结合部腺癌的Ⅰb/II期研究初步结果:在19例可进行疗效评估的受试者中,患者的客观缓解率 (ORR) 达到了57.9%,疾病控制率 (DCR) 达到94.7%,同时安全性良好。
在9月ESMO 2020 上公布的一项 I 期临床试验最新结果显示,AK104用于治疗晚期间皮瘤的客观缓解率 (ORR) 为20.0%,疾病控制率(DCR) 达到了80.0%,最长缓解持续时间 (DoR) 超过 12.9 个月。
基于目前良好的抗肿瘤疗效与安全性表现,AK104注射液有望成为优于PD-1抗体单药的新一代肿瘤免疫治疗手段。
FDA授予快速通道资格
2019年4月,AK104注射液的临床试验IND获得了FDA批准,将在美国开展针对多种恶性肿瘤的临床试验,最先将用于二线治疗复发或转移性宫颈癌的临床研究。今年8月中旬,FDA授予了AL104注射液快速审批通道资格(FTD)。
国内外多项适应症处于临床阶段
在ClinicalTrails.gov 中,康方生物AK104注射液共登记了11项临床试验,包括了单药治疗方案及联合用药治疗方案,适应症涉及到黑色素瘤、T细胞淋巴瘤、宫颈癌、肝细胞癌、鼻咽癌、胃癌等多个类型的肿瘤,拟招募人数约为999人。
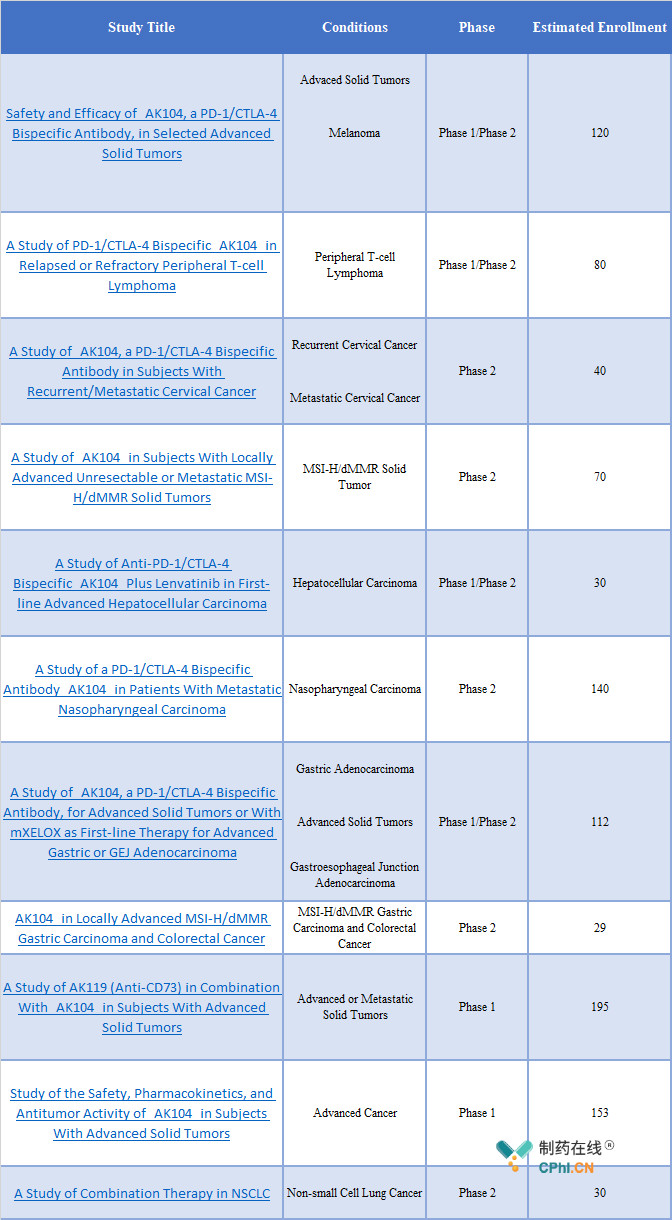
资料来源:ClinicalTrails.gov
在国内,康方生物AK104注射液在药物临床试验登记与信息公示平台中共公示了6 项临床研究,适应症涉及到肝细胞癌、鼻咽癌、胃癌等实体瘤。
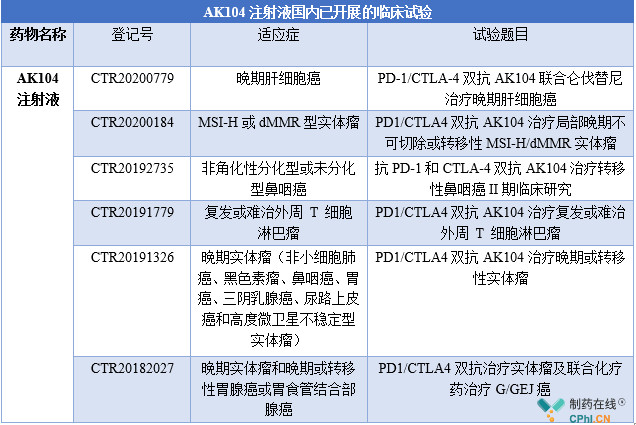
资料来源:药物临床试验登记与信息公示平台
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57