2020年由于受到新冠疫情的影响,制药行业国际间的GMP合规检查明显减少。由于各国防疫政策限制和交通受阻,国际检查不仅仅频率下降,检查方式也多采用书面设计或者远程审计。下面笔者汇总和盘点2020年度中美欧三方的检查数据,并对2021年检查趋势的发展进行预测,希望可以为制药同仁提供借鉴。
第一部分:FDA检查数据汇总分析
2020年FDA对于境外企业检查也因为疫情影响,明显减弱。从目前公布数据看,FDA主要把精力集中于美国境内药品生产企业的合规检查。根据FDA官网最新公开的数据,在2020年度FDA对6家对中国企业签发了警告信,相比于2019年的15封警告信、2018年19封警告信、2017年22封警告信,数量明显减少。
表1:2020年FDA对中国企业发出的警告信一览表
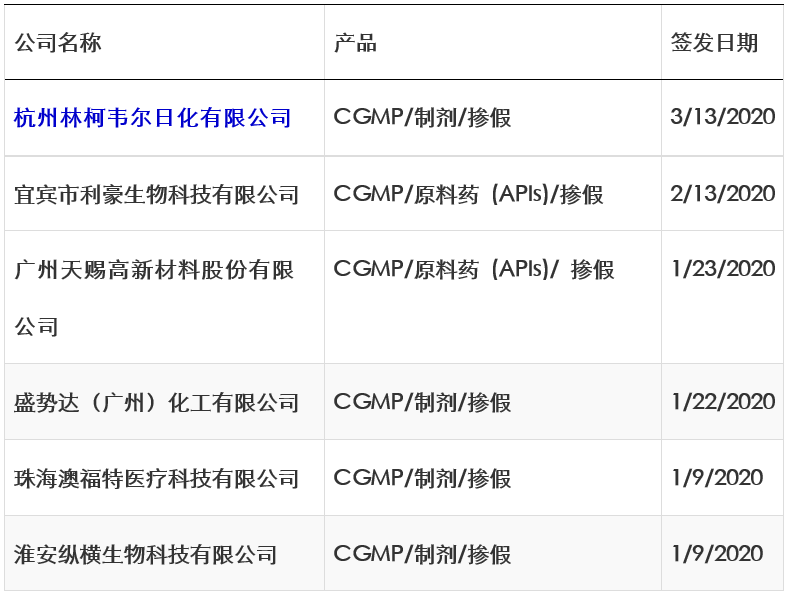
从这些警告信中,我们可以看到一些日化和医疗产品企业的GMP水平仍有待提高,如警告信中提到在产品的QC检测及质量管理方面有诸多缺陷。这些缺陷在多个公司的警告信中存在共性趋势:如未对每批药品进行适当的实验室检测,以确定其符合药品最终质量标准,包括每种活性成分的鉴别和含量;放行之前并未检测药品其所标示的某些活性成分,某些产品缺少鉴别和含量检测等等。
在2020年度,FDA对印度企业签发的警告信数量要多于中国企业。但是如果仔细分析,发现这些警告信所涉及的现场检查多发生在2019年度,也就是新冠疫情爆炸之前。
第二部分:欧盟不符合报告(NCR)数据分析
根据欧盟GMP数据库公布的数据,2020年欧盟共签发了四份不合格报告,涉及的国家包括瑞士、奥地利、波兰和印度。
表2 :2020年欧盟不合格报告一览表
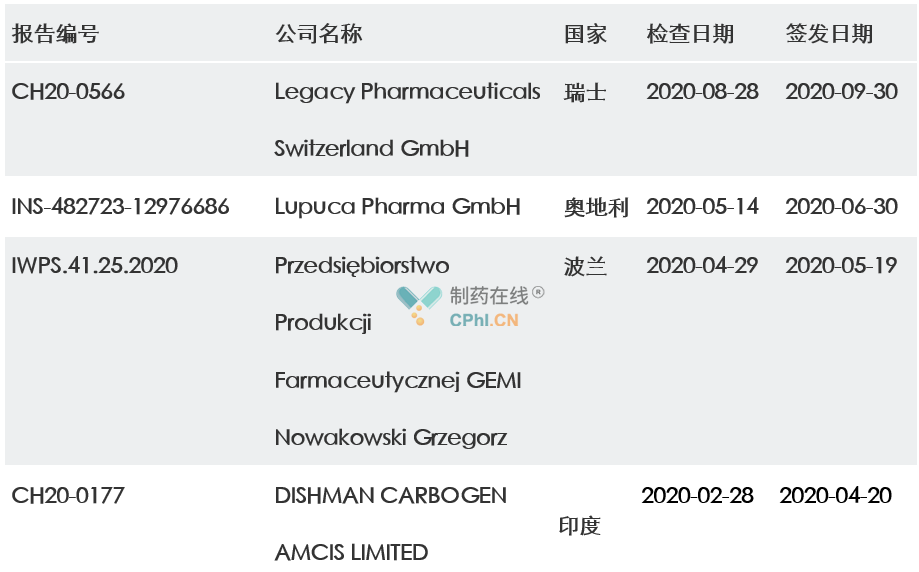
通过对上面这些NCR(不合规报告)进行汇总分析,主要缺陷包括:
◆ 洁净区空气质量控制不足,空气处理系统验证不完整,无菌过滤操作验证不完整; 一些生产线培训基灌装频率不足(每年少于2次); 培训基灌装时发生的偏差未及时处理; 偏差管理不足等;虽然公司的质量体系在正常运行,但缺乏管理监督,因此整体判断公司的无菌生产管理不符合GMP。
◆ 公司持有的生产许可资质是有限的,根据公司的CAPA评估,不能延长其有效期。另外无法解决供应商确认、变更管理、偏差管理、设备确认、计算机系统验证以及文件规范方面的主要系统缺陷。
◆ 未采取措施防止微生物和霉菌污染,交叉污染以及在监测和质量控制过程中未对污染进行适当的调查。 设备和厂房未能正确清洁和维护。 制造商没有足够的存储区域来确保生产过程中药品的受控条件。
◆ 物料管理方面包括标签可追溯性、存储条件、分发和清洁,对原料、中间体、溶剂和回收溶剂的有害生物控制不符合EU GMP标准。未能在多用途设施中减轻交叉污染的风险;并且不知道在采样、分配和合成领域引入新的化学实体之前应采取的必要措施。溶剂的回收没有适当的管理和记录,清洁验证及工艺验证有缺陷。关键偏差和主要偏差未有效处理。
随着新冠肺炎疫情持续发展,欧盟跨国检查也受到影响。因此欧盟发布远程审计指南,鼓励各成员国积极采用新的审计手段以确保药品生产企业符合EU GMP。例如,德国对浙江京新采用远程审计,最后确认浙江京新符合EU GMP。
第三部分:NMPA检查数据汇总
NMPA每年都有自己的年度药品境外检查计划。随着新冠疫情的发布,NMPA下属的CFDI并未发布自己的2020年度境外检查计划,估计是根据上一年度遗留计划和结合风险评估确定的最新检查任务。
根据国家药监局的公告,2020年8月国家药监局暂停了进口日本SANYO CHEMICAL LABORATORY CO., LTD.的盐酸甲氧那明,各口岸所在地药品监督管理部门暂停发放该产品的进口通关单。主要原因是日本SANYO CHEMICAL LABORATORY CO.,LTD.不接受国家药品监督管理局对其盐酸甲氧那明生产现场的现场检查,依据《药品医疗器械境外检查管理规定》,视为拒绝检查情形,直接判定为该企业生产过程不符合我国《药品生产质量管理规范(2010年修订)》要求。
另外,2020年9月国家药监局暂停进口、销售和使用POLICHEM S.R.L.硝呋太尔片和硝呋太尔阴道片,主要原因是在国家药监局对该公司进行的境外检查中发现硝呋太尔片产品存在企业未能按要求对检查发现的缺陷提交整改计划并进行有效整改的问题,硝呋太尔阴道片产品种存在实际工艺与申报工艺不完全一致,影响产品关键质量属性等的问题,不符合我国《药品生产质量管理规范(2010年修订)》要求。
不仅如此,在新冠疫情爆发初期,由于中国境内出差也受到影响,因此CFDI的很多现场核查工作也受到影响。为了弥补这些差距并持续推进工作,CFDI和各省局核查机构积极合作,采取多样方式来完成2020年度核查任务。
在2020年12月7日,CFDI发布《核查中心2020年药品注册联合核查工作进展情况(截至11月底)》,展示了最新境内核查数据:
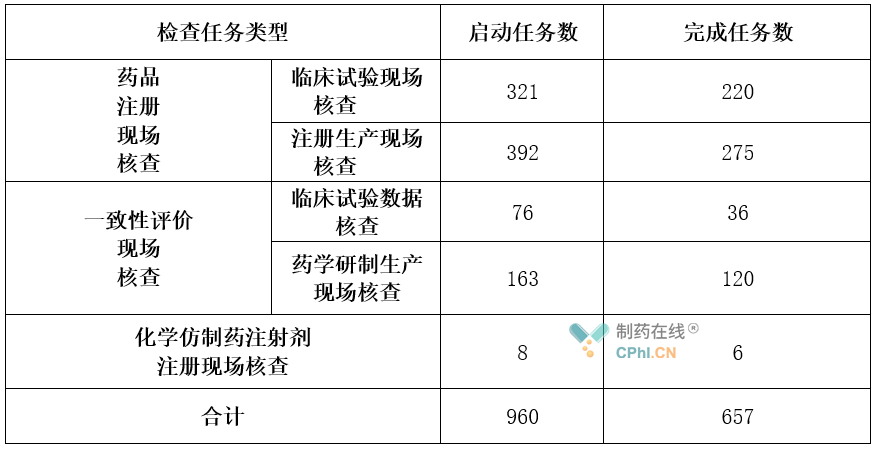
第四部分:未来情况预测
通过对上面数据汇总和分析,预测2021年境内外检查情况,将展示如下特点:
第一. 更多机构将采用书面审计或者远程审计方式来完成合规任务,例如FDA、EU和WHO。
第二. 当企业接收书面审计或者远程审计后,如果符合要求,证书有效期也会缩短。例如暂定为1年有效期。
第三. 中国CFDI对境内企业检查将保持常态化。
第四. 中国CFDI对境外检查,在2021年上半年还会采用书面审计为主的方式;将在2021年下半年逐步采用现场检查的方式。
参考文献
1- NMPA官网数据
2- CFDI官网数据
3- EMA官网数据
4- FDA官网数据
5- WHO官网数据
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57