1月8日,CDE官方网站显示,深圳微芯生物生物旗下在研抗肿瘤1类新药西奥罗尼的临床试验已获得了受理承办,这款三通路选择性激酶抑制剂即将再添一项临床试验。

资料来源:CDE
目前,在微芯生物的产品管线中,已上市的西达本胺是公司营业收入及利润的主要来源,西格列他钠已完成了Ⅲ期临床试验,西奥罗尼是微芯生物继西达本胺、西格列他钠之后的第三个原创1类新药。
三通路选择性激酶抑制剂
西奥罗尼是微芯生物自主设计和开发的具有全球专利保护的新化学结构体,属于多靶点蛋白激酶抑制剂,是化药1类原创新药,拟用于抗肿瘤治疗。
作为一款三通路选择性激酶抑制剂,西奥罗尼可选择性抑制Aurora B、CSF1R和VEGFR/PDGFR/c-Kit等多个激酶靶点,实现肿瘤血管生成抑制、肿瘤细胞有丝分裂抑制及肿瘤免疫微环境调节的三重综合性功能。
特别的,与其他抗血管生成治疗药物有着明显不同,西奥罗尼通过抑制小细胞肺癌潜在异常活跃的Aurora B通路相关分子机制,在进展或复发的小细胞肺癌(SCLC)的单药治疗领域值得期待。
临床试验布局
2013年8月,微芯生物西奥罗尼首次获得原国家食品药品监督管理局颁发的I期临床试验批件。截至目前,在药物临床试验登记与信息公示平台中,西奥罗尼公示的临床试验共计7项,其中的4项处于已完成状态,临床适应症涉及到非霍奇金淋巴瘤、卵巢癌、肝细胞癌等。
从已完成的多项单药或联合治疗结果来看,西奥罗尼针对不同类型恶性肿瘤的治疗均显示出积极的临床疗效和良好的人体安全耐受性。
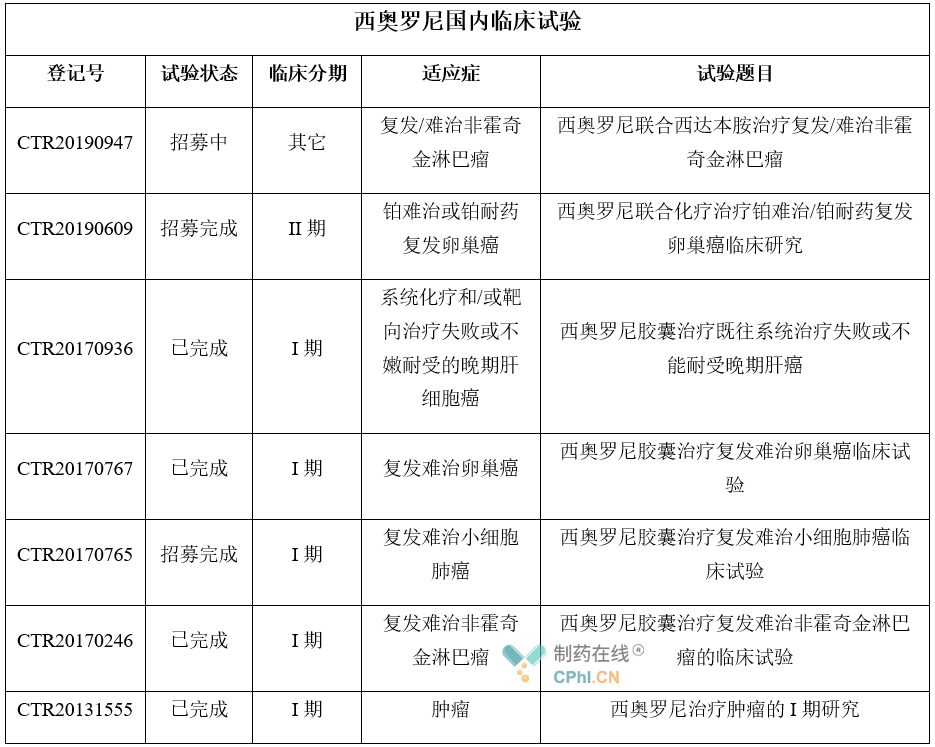
资料来源:Chinadrugtrials
2020年12月底,西奥罗尼胶囊被CDE正式纳入了突破性疗法认定公示名单,进入了以适应症上市审批为目标的确证性III期临床试验,适应症为单药治疗经过2线系统化疗方案治疗后疾病进展或复发的小细胞肺癌(SCLC)。西奥罗尼在前期的临床试验中,针对多线治疗失败的患者,相比于历史对照数据,其单药治疗取得了十分积极的疗效结果,有可能为小细胞肺癌患者带来更优的治疗选择。
除了国内的临床试验布局之外,微芯生物已经与FDA就西奥罗尼小细胞肺癌的临床开发完成了preIND沟通,下一步即将在海外进行临床试验。
西奥罗尼与伴随诊断产品的联合开发
除了药物治疗的临床试验布局之外,微芯生物同时也借鉴了欧美等规范性市场的做法,率先布局了西奥罗尼与伴随诊断产品的联合开发。
去年10月初,微芯生物与北京诺禾致源公司签署了《微芯生物-诺禾致源伴随诊断产品开发合作框架协议》,这一框架协议的主要内容是借助诺禾致源为西奥罗尼开发针对小细胞肺癌患者的伴随诊断检测方法,并其提供临床试验样本的检测服务;同时,两家公司将共同推动西奥罗尼与该伴随诊断产品在国家药品监督管理局(NMPA)的批准上市。
从海外规范市场的实践来看,这种靶向药物与伴随诊断产品联合开发的方式有助于提高新药的研发效率和成功率,微芯生物就西奥罗尼的开发是一种新的尝试,值得借鉴。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57