2019年底突然爆发的新型冠状病毒肺炎疫情到目前为止还没有被完全控制,不仅欧美国家由于对于疫情的忽视导致情况愈演愈烈,国内某些地区疫情也多次发生反复。新冠疫情不仅对各个行业产生持续影响,也对广大人民群众的生活产生了较大影响。因为新冠疫情的爆发,从中国中央政府到各行政部门都认识到生物安全的重要性,因此在2020年度不断修订、完善和推出新的涉及生物安全的法规,来不断强化对生物安全的预警、评估、控制能力。
制药行业在抗击新冠疫情工作中展示了作用和持续抗压性,已经让整个社会认识到中国制药行业的实力和影响。同时,制药行业由于生产工艺特殊性和使用物料的特殊性,也需要持续强化生物安全的预警、评估和控制。
本文汇总2020年度发布的和医药行业相关的法规和技术文件,梳理流程,希望可以为制药行业持续提高生物安全管理提供帮助。
第一部分:生物安全相关法规汇总
表格1-2020年度涉及生物安全法规一览表
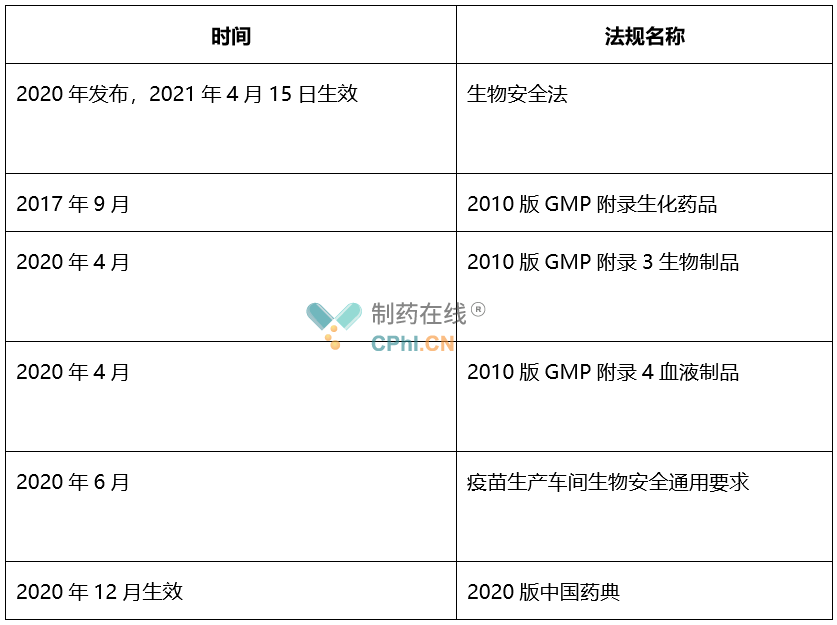
第二部分:新发布生物安全法对制药行业影响
因为近几年连续发生各类生物安全案件,同时因为2019年末爆发的新冠疫情持续发酵,对社会各方面都提出要规范生物安全管理的需求,因此在2020年颁布了《生物安全法》。
《生物安全法》共10章节、88条,包含11条术语。其中和医药行业相关的章节是第四章生物技术研究、开发与应用安全、第五章 病原微生物实验室生物安全、第六章人类遗传资源与生物资源安全。
新颁布的《生物安全法》体现了如下特点:
第一、进行新型生物技术研究,必须获得伦理审核批准。
引发世界关注的贺建奎案件,暴露了中国过去对于生物技术研发和应用方面伦理审核的缺陷和不足。2019年1月21日,从广东省"基因编辑婴儿事件"调查组获悉,现已初步查明,该事件系南方科技大学副教授贺建奎为追逐个人名利,自筹资金,蓄意逃避监管,私自组织有关人员,实施国家明令禁止的以生殖为目的的人类胚胎基因编辑活动。
第二、强化涉及生物安全的重要设备和特殊生物因子管控
《生物安全法》第三十九条规定:国家对涉及生物安全的重要设备和特殊生物因子实行追溯管理。购买或者引进列入管控清单的重要设备和特殊生物因子,应当进行登记,确保可追溯,并报国务院有关部门备案。个人不得购买或者持有列入管控清单的重要设备和特殊生物因子。应该说,这一条从物质基础方面对涉及生物安全的研究实施了有效管控。
第三、强化病原微生物实验室管理要求
《生物安全法》第四十三条规定:国家根据病原微生物的传染性、感染后对人和动物的个体或者群体的危害程度,对病原微生物实行分类管理。从事高致病性或者疑似高致病性病原微生物样本采集、保藏、运输活动,应当具备相应条件,符合生物安全管理规范。具体办法由国务院卫生健康、农业农村主管部门制定。
在过去一段时间,不管是中国境内,还是欧美国家都发生了一些实验室泄露的事件,产生了不良影响。从病原微生物实验室入手管控,是有效手段之一。
第四、强化风险应对和管控措施
《生物安全法》第五十条提到:病原微生物实验室的设立单位应当制定生物安全事件应急预案,定期组织开展人员培训和应急演练。发生高致病性病原微生物泄漏、丢失和被盗、被抢或者其他生物安全风险的,应当按照应急预案的规定及时采取控制措施,并按照国家规定报告。这个要求提出,就是体现了管控要求的动态化。从过去只是重视审批到对实验室管控团队提出应对要求,体现了管控措施的务实性。
第五、强化了法律惩罚手段
在《生物安全法》的第九章法律责任中对于各类违法行为进行了细致规定。江苏南京某企业负责人被抓捕、上海施贵宝公司被警告,都体现了法律责任的强化趋势。
第三部分:GMP涉及生物安全内容修订情况
通过梳理,本文汇总了2010版GMP对生物安全的相关要求,参见下表:
表格2-GMP附录涉及生物安全的技术要求

从上面这些文件可以看出,要符合新修订文件要求,各企业都需要在硬件和软件方面投入很多资金和精力,才能符合最新要求。
第四部分:**行业面对的生物安全提高要求
随着新冠疫情持续发酵,各国医药技术团队都在争分夺秒的研发新型**。这既是为了人类幸福和生命安全,也是各国综合实力竞争的体现。为了确保国内**企业规范开发研发和生产,2020年6月,科技教育司发布《关于印发**生产车间生物安全通用要求的通知》
对**车间生物安全评估提出具体要求。
《**生产车间生物安全通用要求》共包括12个章节,分别是 范围、术语和定义、风险管理、防护水平分级、机构与人员、车间与设施、生产设备、验证和评估、文件管理、安全管理、生物安保、安全控制和持续改进。这份文件体现了显著变化:
第一、对于组织提出强化要求
例如文件规定:企业应建立生物安全管理组织机构。企业的法定代表人、主要负责人全面负责本企业**生产中的生物安全。企业应设立生物安全委员会,其成员包括(不限于)生物安全负责人、质量管理负责人、生产管理负责人、车间负责人、设施设备管理负责人。企业生物安全委员会负责组织、评估、审核并批准车间的生物安全防护水平等级;审核并批准生物安全管理体系文件、风险评估报告等。企业可设立生物安全专家委员会,提供生物安全相关的咨询、指导等,可聘任外部专家。
而且文件还赋予了生物安全负责人的独立实施权力的保证。例如文件规定:企业应设生物安全负责人,负责生物安全管理事宜,当发现存在生物安全隐患时,具有立即停止相关生产活动的权限。生物安全负责人应当具有相应的专业知识,具有医学、药学等相关专业本科及以上学历(或中级及以上职称),并具有5年以上从事相关领域管理经验。生物安全负责人与车间负责人不能为同一人。
第二、对于**车间和设备都提出了强化要求
例如针对车间的不同风险级别,规定很具体:应将防护区内气压控制为相对室外大气负压。涉及病原微生物操作的核心工作间(区)的气压(负压)与室外大气压的压差值应不小于40Pa,与相邻工作走廊(或缓冲间)的压差(负压)应不小于15Pa,其余房间与室外方向上相邻相通房间的最小负压差应不小于10Pa。
又例如文件规定:车间的外部排风口应设置在主导风的下风向(相对于新风口),与新风口的直线距离应大于12 m,应至少高出本车间所在建筑的顶部2 m,应有防风、防雨、防鼠、防虫设计,但不应影响气体向上空排放。
第三、要求生物安全体系持续自检和改进
针对人类对所涉及的生物安全因子认识不断深入的规律,文件提出,要每年定期自检,并持续改善和提高生物安全管控体系。
总结和建议
总之,通过对上面这些新发布的法律和法规的要求分析,可以看出从国家各个层面都提出越来越多的技术要求。企业不管是新建工厂和实验室,还是对旧的工厂和实验室改造,都需要符合最新法规,并持续完善和管控生物安全。
说明:本文不构成任何投资建议和参考。
参考文献
1- 生物安全法
2- 2010版GMP附录3生物制品
3- 2010版GMP附录4血液制品
4- **车间评估
5- NMPA官网信息
6- CDE官网信息
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57