在2021年1月份,FDA继续秉持公开透明的工作原则,发布了2021年度CDER的指南修订和制订工作计划《CDER Guidance Agenda-New & Revised Draft Guidance Documents Planned for Publication in Calendar Year 2021》。从这份年度工作计划中,可以看出FDA将在多个监管领域启动指南文件的修订和制订工作,并进一步影响国际制药行业。笔者通过对这份文件的整体解读和重点解读,希望可以为中国制药同仁提供借鉴。
第一部分:2021年度指南整体工作安排
根据这份指南的工作计划,我们可以看到,在2021年度,FDA将在多个领域对多份指南文件启动修订和制订计划。信息梳理参见下表:
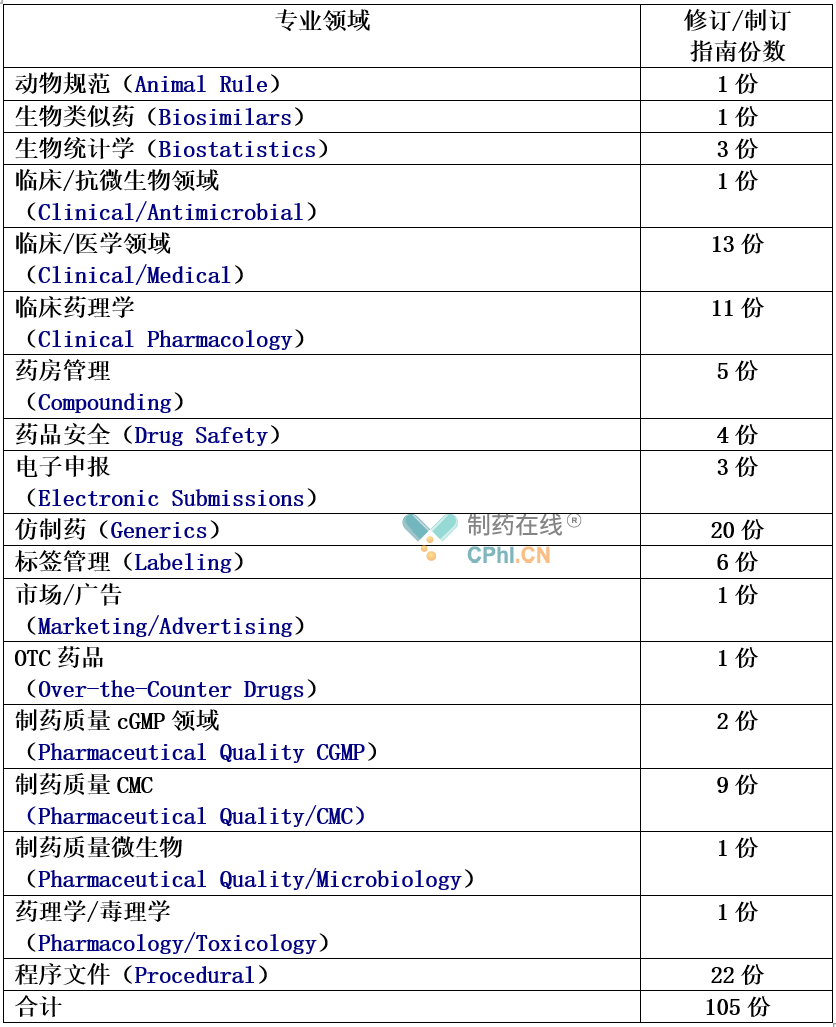
根据上面表格统计,预计在2021财年FDA将修订和制订105份指南;评估每个月要发布9份文件,应该说,这个工作量不低。
第二部分:重点指南和领域介绍
◆ 生物类似药被持续关注
因为美国境内持续高启的医保费用,FDA也想通过推动生物类似药不断上市来提高竞争,进而减轻医保费用压力。但是由于美国FDA对于生物类似药的使用采用更严格的政策,因此一个生物类似药获得批准后,不能直接和参比生物制品进行替代使用。生物类似药要想替代参比生物制品,必须按照Interchangeable Biological Product的要求来研发和申报,才可能在获得批准后,和参比生物制品进行临床使用的互换。为了指导行业研发生物类似药和可以互换的生物制品,FDA将发布指南《Product Class-Specific Recommendations for Developing Biosimilar and Interchangeable Biological Products》,对相关技术进行规定。
◆ 临床药理学多个领域有变化
为了指导制药企业在临床研发中合理选择药物剂量,FDA将发布《Dose Selection in Drug Development》解释这个问题;应该说,对于创新药企业,这是一个值得关注的方向。另外,药物在临床使用时往往处于复杂的环境,会存在多种药物共用的情况。为了指导企业评估多药物共用的风险,FDA将发布指南《Drug-Drug Interaction Assessment for Therapeutic Proteins》来解释工作思路。
◆ 仿制药领域有多项工作值得关注
首先,为了指导制药企业提高申报质量,在过去FDA已经发布了三份RTR指南。在这份最新的工作计划中,FDA将继续发布2份RTR指南:《ANDA Submissions - Refuse-to-Receive for DMF Facilities Deficiencies》和《ANDA Submissions - Refuse-to-Receive Standards: Questions and Answers》。毫无疑问,这些被称为枪毙性条款的指南,必将引发中国制药行业关注。
再者,仿制药一致性概念将被强化和深度解释。中国已经启动6年多的一致性评价项目其实题目是错误的,不应该叫"质量和疗效一致性",而应该称为"疗效一致性评价";因为仿制药质量属性可以和参比药品质量属性可以不一致。对于口服普通制剂,为了证明仿制药和参比药品的疗效一致性,可以采用BE试验,甚至采用验证性临床来证明一致;对于其他药品,怎么判断治疗效果一致性呢?FDA新指南《Evaluation of Therapeutic Equivalence》会给出最新认知。
最后,皮肤用药的Q3特征将被给予最新认知。在注射剂一致性评价中,行业普遍认知是最少达到Q1/Q2标准;而在某些特殊药品中,Q3标准也被提及。对于皮肤用药如何判断Q3,Q3对于皮肤用药的研发决策有什么影响,FDA指南《Physico-Structural (Q3) Characterization of Topical Dermatological Drug Products Submitted in ANDAs》将给出最新答案。
◆ GMP管理领域的最新变化
FDA将修订《PET Drugs - Current Good Manufacturing Practice (CGMP)》,对PET产品的GMP管理要求给出最新标准。同时,制药行业持续关注的交叉污染问题,也促使FDA将修订《Non-Penicillin Beta-Lactam Drugs: A CGMP Framework for Preventing Cross-Contamination》来做出应对。
◆ CMC领域的最新动向
稳定性试验是药品研发和上市后管理的重点内容,FDA将发布《ANDAs: Stability Testing of Drug Substances and Products Questions and Answers》来对此问题进行深入阐释。
ICH Q12指南主要管理药品上市后变更。如果某个药政当局积极实施ICH Q12的管理思想,应该可以让药品上市后变更变得更合理和人性化。目前,欧盟、日本和FDA都积极组建团队以促进ICH Q12的实施。FDA将发布《ICH Q12, General Considerations for FDA Implementation》来解释对此问题的最新态度。
可见异物是注射剂产品的关键质量属性,也是影响用药安全的关键因素。FDA将发布《Inspection of Injectable Products for Visible Particulates》来强化对此问题的监管。
◆ 口服药品微生物质量属性控制
对于口服药品,是否都不需要检测微生物限度?哪些需要测试?测试标准如何科学设定?FDA将发布《Microbiological Quality Considerations in Non-Sterile Drug Product Manufacturing》来解释这个问题。
◆ 强化对真实世界证据的应用
随着世界各国药政机构纷纷发布真实世界证据法规,FDA也对类似问题给予了澄清。在2021年度,FDA将发布《Real-World Data: Assessing Electronic Health Records and Medical Claims Data to Support Regulatory Decision-Making for Drug and Biological Products》和《Regulatory Considerations for the Use of Real-World Data and Real-World Evidence to Support Regulatory Decision-Making for Drugs and Biological Products》2份指南,对此问题给出更具体的指导。
总结
通过上面的介绍和分析,可以看出在2021年度,FDA将在多个领域更新监管要求和思想。希望致力于开拓美国市场的中国企业积极研究,为即将到来的最新监管要求做好准备。也希望这些最新技术指南,可以促进中国医药行业的相关工作开展。
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57