2月23日,康方生物官方公告,旗下自主研发的全球首创新型肿瘤免疫PD-1/CTLA-4双特异性抗体新药AK104注射液即Cadonilimab获得了美国食品药品监督管理局(FDA)授予的孤儿药资格认定,用于治疗宫颈癌(除极早期IA1期之外)。
根据美国的《孤儿药法案》,凡获得孤儿药资格的候选药物,有机会获得为期7年的市场独占权,以及包括税收减免、生物制品许可证申报费减免、处方药用户费用减免、研发资助、方案协助和快速监管审批通道等在内的一系列配套支持政策。
First-in-Class定位的 PD-1/CTLA-4 双特异性抗体
AK104注射液即Cadonilimab是康方生物公司基于其专有的TETRABODY 技术,自主研发的、潜在下一代 First-in-Class定位的 PD-1/CTLA-4 双特异性肿瘤免疫治疗药物,也是全球首 个进入临床试验的PD-1/CTLA-4双特异抗体。
通过优化抗体的结构设计,AK104能够更多的与共表达的TIL进行四价结合,区别于缺乏检查点共表达且仅允许二价结合的外周位点淋巴细胞,能更好地结合在TIL细胞表面,从而优先在肿瘤微环境中富集。这种结构上的优化设计使得AK104保留了PD-1及CTLA-4两个靶点的有效性,同时大幅提升了安全性。
广泛开展的临床试验
作为公司的核心产品,AK104注射液于2017年获得了国家卫健委及科技部十三五重大新药创制科技重大专项的支持,康方生物围绕AK104开展了广泛的临床研究:药物临床试验登记与信息公示平台公开的信息显示,AK104注射液的临床试验有9项,临床适应症涉及到晚期肝细胞癌、局部晚期或转移性非小细胞肺癌、非角化性分化型或未分化型鼻咽癌、复发或难治外周T细胞淋巴瘤、晚期或转移性胃腺癌或胃食管结合部腺癌。
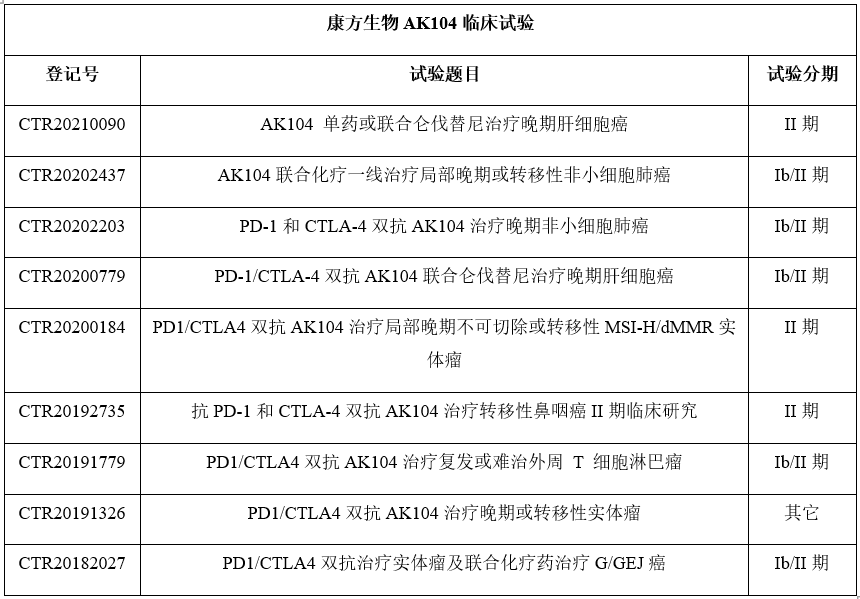
资料来源:Chinadrugtrials
在宫颈癌、胃癌等多种肿瘤的研究阶段性初步资料显示,AK104比PD-1联合CTLA-4的联合疗法相比,**显著降低,具有明显的安全性和疗效优势。
在海外市场中,AK104正在澳大利亚、新西兰、 美国开展了二线/三线治疗复发或转移性宫颈癌的单臂注册性临床试验,布局的主要适应症还包括了肝癌、胃癌、肺癌、食管鳞癌及鼻咽癌等。
有望改善宫颈癌治疗
在此次孤儿药资格获取之前,AK104注射液用于宫颈癌治疗已经在中美两地获得了重要进展:2020年8月,AK104治疗晚期宫颈癌的临床试验获得了FDA授予的快速审批通道资格(FTD);2020年10月,AK104用于治疗复发或转移性宫颈鳞癌,获得了NMPA审核同意,纳入"突破性治疗品种公示"名单。
目前,AK104注射液在中国用于经标准治疗后复发或转移性宫颈癌的注册性II期临床试验已经完成患者入组。
对于宫颈癌患者的药物治疗而言,含铂药物化疗治疗失败之后,目前尚无获批的标准药物治疗方式。后线化疗治疗的客观缓解率(ORR)不足10%,无进展生存时间短,患者的长期化疗耐受性差,不良反应发生率较高,治疗需求尚未满足,极需要有效的治疗药物来提高疗效获益。鉴于AK104兼具明显安全性和疗效的优势,这款药物有望在未来改善宫颈癌患者的治疗现状。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57