2021年3月23日,基石药业申报的RET抑制剂普拉替尼(pralsetinib)新药上市申请审评审批状态更新为"审批完毕-待制证",这意味着该药已正式获批。适应证为用于治疗既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。此次普拉替尼的获批意义重大,不仅标志着中国迎来了第一个获批的RET抑制剂,也标志着基石药业迎来了第一个商业化产品。
不仅如此,在3月18日,基石药业申报的KIT和PDGFRA突变激酶抑制剂阿伐替尼 (avapritinib)新药上市申请(NDA)也进入"在审批"状态,适应证为特定不可切除性或转移性胃肠道间质瘤(GIST)成人患者。对于基石药业而言,可谓双喜临门。一起来看下这两款新药。
RET抑制剂--普拉替尼
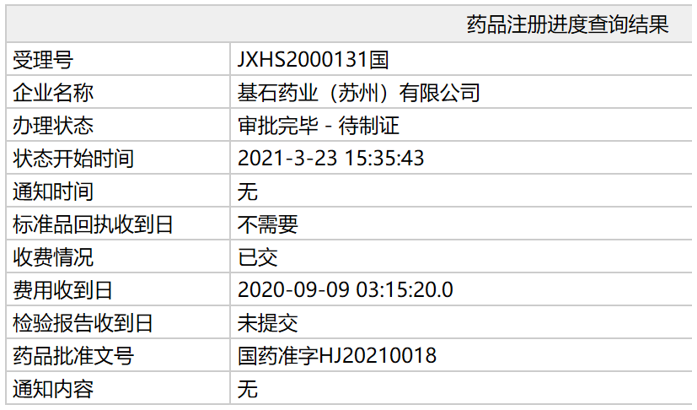
来源:NMPA官网
普拉替尼是Blueprint Medicines开发的一款强效、高选择性靶向致癌性RET变异(包括可预见的耐药突变)的口服精准疗法,基石药业于2018年6月获得了该产品在大中华区的独家开发和商业化授权。在美国,该药已被FDA批准用于治疗转移性RET融合阳性NSCLC的成人患者、需要系统性治疗的晚期或转移性RET突变甲状腺髓样癌成人和12岁及以上儿童患者,以及需要系统性治疗且**碘难治(如适用)的晚期或转移性RET融合阳性甲状腺癌成人和12岁及以上儿童患者。
在中国,普拉替尼的上市申请于2020年8月被中国国家药监局药品审评中心(CDE)纳入优先审评,拟用于既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性NSCLC患者的治疗。
临床研究
ARROW是一项全球注册Ⅰ/Ⅱ期研究,研究旨在探索普拉替尼治疗RET变异实体瘤的临床活性和安全性。研究包括Ⅰ期剂量递增(30~600 mg Qd/Bid)和Ⅱ期剂量扩展(400 mg Qd)试验,研究分别入组了RET融合阳性NSCLC、RET突变MTC(甲状腺髓样癌)、RET融合阳性TC(碘难治甲状腺癌)和RET融合其他实体瘤4个队列,主要终点是客观缓解率(ORR)和安全性。
研究结果:可评估疗效患者12例,ORR可达50%,疾病控制率(DCR) 92%,所有胰 腺癌和胆管癌患者均有反应。
截至2020年2月13日,6例患者仍在持续治疗,大多数不良事件(AE)都为1~2级,最常见的治疗相关AE(TRAE,≥15%)包括丙氨酸转氨酶升高(43%)、天冬氨酸转氨酶升高(36%)、贫血(29%)、中性粒细胞减少(29%)、白细胞减少(29%)和高血压(29%)。治疗持续时间达20.8个月,没有患者因为TRAE停药。
研究中,1例携带NCOA4-RET融合的51岁胆管癌患者接受普拉替尼治疗后,靶病灶缩小64%,持续反应时间长达20个月,疗效远远超出现有标准治疗模式。
研究证实,不论RET融合伴侣类型及接受过什么类型的治疗,普拉替尼均证明在多种RET融合晚期实体瘤中具有广泛而持久的抗肿瘤活性,且耐受性好。
KIT和PDGFRA突变激酶抑制剂--阿伐替尼
GIST是一种常见的间叶源性的胃肠道肿瘤,约85%由编码KIT或血小板源性生长因子α(PDGFRA)受体酪氨酸激酶的癌基因突变驱动,其中PDGFRA外显子18 D842V突变占GIST总人群的5%~6%。
目前,中国晚期GIST治疗主要为依次使用TKIs,但已批准的TKI药物对携带PDGFRA外显子18 D842V突变的GIST患者疗效甚微,对其它罕见PDGFRA外显子18突变也疗效欠佳。
NAVIGATOR研究的成功,一举打破了这类患者的治疗僵局,阿伐替尼成为该类患者的高效药物。
NAVIGATOR研究是Avapritinib在晚期GIST患者中开展的 I期临床试验。2018年结缔组织肿瘤学会(CTOS)年会上,研究者公布了该研究结果:在既往接受过四线或以上治疗的晚期 GIST 患者(109例)中,avapritinib的ORR为 20% ,DOR为 7.3个月;既往未接受过瑞戈非尼治疗的三线/四线治疗患者(23例)中,avapritinib的ORR 为 26% ,中位DOR 为 10.2 个月。值得关注的是,在PDGFRA D842V 突变的 GIST 患者(56例)中,avapritinib的ORR 达到了84% ,12个月的mDOR为 76.3%,12个月的PFS为 81.3%。
2019 年ASCO和CTOS大会上,研究者再次更新了NAVIGATOR的研究数据。对于既往至少接受过 2 种TKI(包含伊马替尼)治疗进展的无法切除的 PDGFRα 基因 D842V 突变或其他突变的 GIST 成年患者给予 avapritinib 口服治疗。评估 avapritinib 在四线及以上和 PDGFRα 外显子 18 突变 GIST 中的疗效和安全性。截至 2018年11月16日,共纳入 237 例患者。其中包括 111 例四线及以上患者(主要为KIT突变)和 43 例 PDGFRα Ex 18 患者。43 例 PDGFRA外显子18 突变的 GIST 患者中,avapritinib 的ORR 高达86%,其中3例患者取得CR,临床获益率(CBR)达到95.3%,中位PFS和中位DoR均尚未达到。根据GIST患者的治疗线数进行分析,一线接受avapritinib治疗的患者,ORR达到100%。四线或以上治疗的患者,ORR为 22%,CBR为41%,中位DoR为10.2 个月,中位PFS为3.7个月。安全性分析显示,大多数不良事件为 1~2 级。
阿伐替尼的临床疗效已在全球范围内得到验证和认可。在美国,该药已于2020年1月被FDA批准上市,用于治疗携带PDGFRA外显子18突变(包括PDGFRA D842V突变)的不可切除性或转移性GIST成人患者,这也是首 个在美国获批上市的GIST精准靶向药物。在欧盟,阿伐替尼也已获批用于治疗携带PDGFRA D842V突变无法切除或转移性胃肠道间质瘤成人患者。
2020年9月,阿伐替尼率先落地海南博鳌乐城国际医疗旅游先行区,以使中国患者尽早使用上这款GIST精准靶向创新药物。本次进入"在审批"意味着,阿伐替尼将有望很快惠及更多的中国患者。
基石药业的使命是为癌症患者带来突破性的治疗,通过整合全球最优的医疗资源,以及发展自身以研发为引擎的创新的研发优势,不断地开发出新的突破性的药物,来延长患者的生命,提高患者的生活质量。预计2021年,公司将有4款产品在3个地区获批,覆盖胃肠道间质瘤、肺癌、急性髓系白血病等4个以上适应证,我们拭目以待。
参考来源:
1.Subbiah V, Hu I N,Gainor J F, et al. Clinical activity of the RET inhibitor pralsetinib (BLU-667) in patients with RET fusion+ solid tumors[R]. 2020 ASCO, abs 109.
2.Heinrich M, Jones R, von Mehren M, et al. Avapritinib is Highly Active and Well-tolerated in Patients With Advanced GIST Driven by a Diverse Variety of Oncogenic Mutations in KIT and PDGFRA.CTOS 2018, Abstract no: 3027631.
3.Heinrich M, Jones R, von Mehren M, et al. Clinical activity of avapritinib in ≥ fourth-line (4L+) and PDGFRA Exon 18 gastrointestinal stromal tumors (GIST). ASCO 2019, Abstract 11022.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57