3月29日,根据相关网站显示,君实生物PD-1特瑞普利单抗第3个适应症(受理号:CXSS2000018/19)的上市申请已经变更为"在审批",预计近期获批上市,用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)患者。

(资料来源:药智数据)
据悉,此次新适应症的上市申请是基于一项开放性、单臂、多中心、Ⅱ期关键注册临床研究(POLARIS-03),该研究旨在评估特瑞普利单抗治疗标准治疗失败后的局部进展或转移性膀胱尿路上皮癌患者的安全性和有效性。
根据2020年ASCOGU上公布的临床入组结束后的分析数据,至数据截止日,独立评估结果显示:在符合评估条件的148例患者中,总体客观缓解率(ORR)为25.7%,PD-L1阳性患者(46例,31.1%)ORR达到41.3%;OS数据尚未成熟,安全性数据与特瑞普利单抗过往报道基本一致。
尿路上皮癌(UC)(又叫移行细胞癌(TCC))是目前最常见的一种膀胱癌。据统计,2018年我国大约有82270新增膀胱癌案例,占全世界膀胱癌新增案例的15.0%。相较于其他肿瘤,我国尿路上皮癌治疗药物进展缓慢,治疗仍以铂类为基础化疗为主。目前,国内仅有百济神州的替雷利珠单抗获批尿路上皮癌,君实的特瑞普利单抗将是第2个拿下尿路上皮癌的PD-1。
目前,国产PD-1均已纳入2020年国家医保目录。2019年全球PD-1/L1单抗药物市场规模已超过200亿美元。根据Research and Markets的预测,随着适应症的不断获批和新药上市的持续加速,未来全球PD-1/PD-L1销量将保持23.4%的年复合增长率,至2025年有望达500亿美元。未来3-5年,仍然是PD-1/L1群雄逐鹿的时代。
国内已上市及已报产PD-1/L1
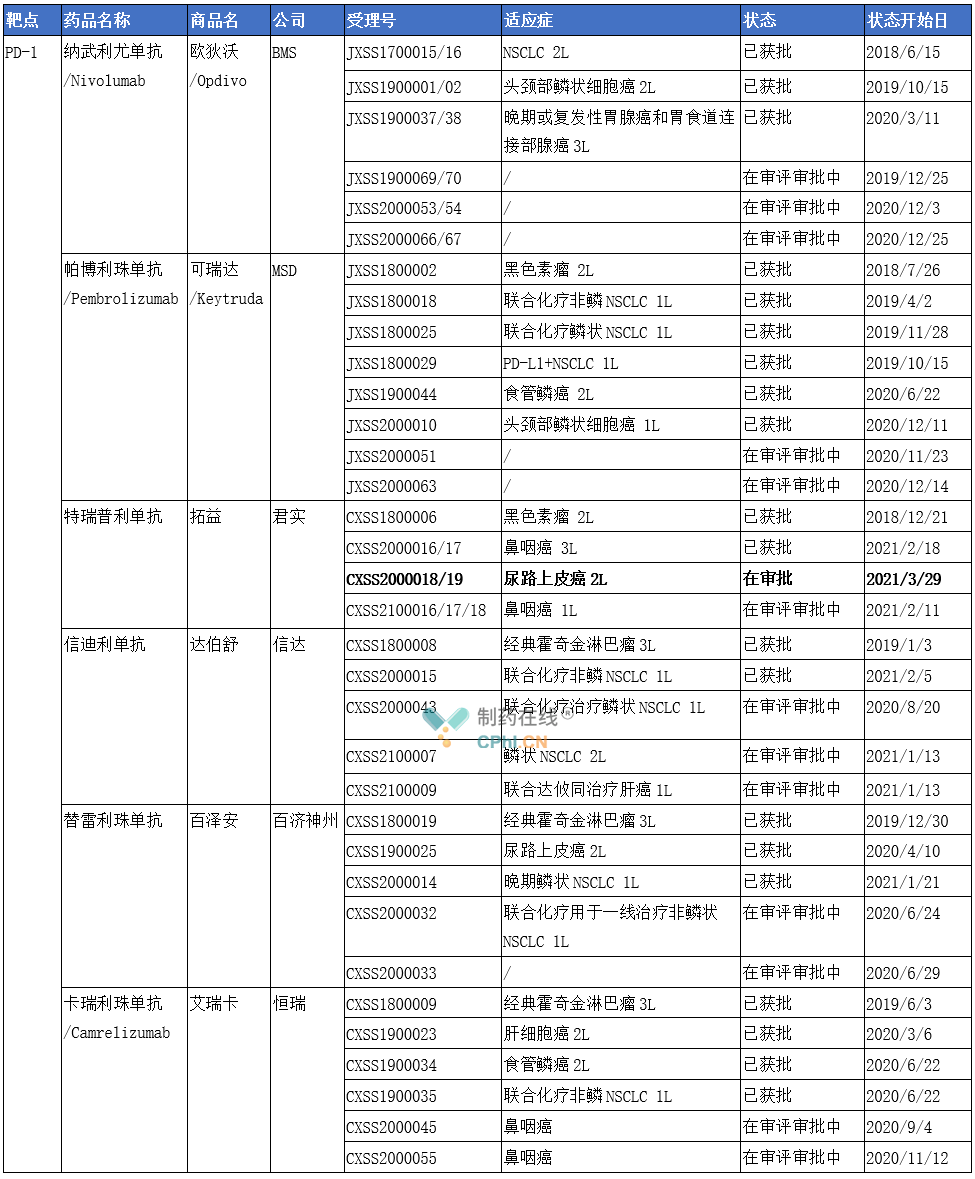
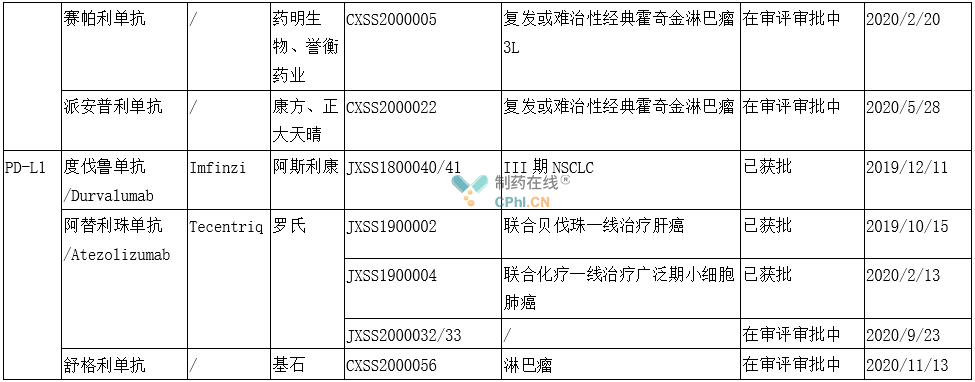
(根据公开资料整理,如有不全处,欢迎留言补充)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57