自 1984 年 Hatch-Waxman法案(《药品价格竞争与专利期补偿法案》)颁布以来,为了促进药品竞争以及提高公众的药品可用性,美国FDA已经制定了多项旨在加快仿制药上市的政策。但随着更新和更独特产品的开发和批准,药品的复杂性也在不断增加。许多药品从简单的小分子发展到具有复杂活性成分、剂型、配方或给药途径的产品以及作为药械组合的产品,复杂药品带来了新的挑战性问题。
A-复杂仿制药的定义
按照FDA的GDUFAII(《仿制药申报者付费法案》)承诺函中的定义描述,复杂产品-一般包括以下几种情况:
1. 具有复杂活性成分的产品(如肽、高分子化合物、复杂的原料药混合物、天然来源的成分);复杂配方(如脂质体、胶体);复杂的给药途径(例如局部作用药物,如皮肤科产品、复杂眼科产品和配制成悬浮液、乳剂或凝胶的耳部剂型)或复杂剂型(如透皮药物、计量吸入器、缓释注射剂)
2. 复杂药物-器械组合产品(如自动注射器、计量吸入器);
3. 其他与批准途径或可能的替代方法有关的复杂性或不确定性将受益于早期科学参与的产品。
对于这些复杂仿制药,因其配方和活性成分复杂,一般使用传统的生物等性性方法很难“仿制”( 例如其配方或给药系统),因此存在的数量较少,导致这些产品的市场竞争也较少。另外一方面,这些产品是Hatch-Waxman法案之初所确定的仿制药批准途径中没有预见的,审评时需要对产品的属性进行特殊评估。近年来,FDA对复杂仿制药也给予了特别的关注,从2014—2020年的每个财政年度,FDA 基本上都将“复杂产品的等效性”列为GDUFA 监管的科学研究重点,努力改善和推进复杂仿制药研发及申报审批流程,提高复杂仿制药申报上市的效率。
B-FDA针对复杂仿制药的推进工作
一方面,FDA发布了系列的特定产品(PSG)指南,这些指南描述了FDA目前对如何开发与特定参比药物等效的仿制药的想法和期望,这样有助于仿制药制药行业确定最适当的方法和证据,以支持特定的仿制药的批准。FDA有PSG指南的数据库,而且会定期更新。
另外,为了特别关注复杂仿制药,FDA专门开辟了针对复杂仿制药PSG的新网页--即将发布的针对复杂仿制药的特定产品指南网页(Upcoming Product-Specific Guidances for Complex Generic Drug Product Development)(图1),每季度FDA发布PSG批次时,该网页会更新一次,每次更新都会删除已发布的PSG,并添加任何正在开发或修订中的新的PSG。该预先通知将帮助仿制药公司计划或规划其对复杂仿制药产品的开发。仿制药申请人也可以具体跟踪FDA计划新增和修订的复杂产品指南,以避免在开发或申请审评方面因指南修订而措不及防 。

图1事FDA的即将发布的针对复杂仿制药的特定产品指南网页
另外一方面,FDA根据2017年仿制药使用者费用修正案(GDUFA II),建立了ANDA提交前计划(pre-ANDA program),其目的在于在药物研发早期通过书面交流和会议明确对申请人的监管期望、协助申请人提交完整申请、提高审评流程的效率以及减少复杂仿制药获批所需要的审批轮次。Pre-ANDA会议有三种类型,分别为药物研发会议(Product development meeting)、提交申请前会议(Pre-submission meeting)、审评中期会议(Mid-review cycle meeting)。该计划特别关注复杂仿制药, 2020年11 月 25 日FDA发布了《GDUFA 下复杂产品 ANDA 申请人与 FDA 之间的正式会议》的定稿指南,概述了产品研发、申报前和中期审评会议三种会议类型、何时举行、申请和开会程序等。 这些会议的召开和充分沟通,将会在工业界和FDA之间架设信息传递的桥梁。
2020年8月1日,FDA授予了马里兰大学和密歇根大学一项为期5年(2020年8月1日至2025年7月31日)的资助,以建立复杂仿制药研究中心 Center for Research on Complex Generics (CRCG)。这项资助旨在加强与仿制药行业的研究合作,以进一步实现OGD的使命,即增加获得安全、有效、高质量和潜在低成本仿制药的机会。CRCG将通过协作研究、培训、讲习班,满足开发需求的实验室项目,复杂仿制药学者计划,以及FDA、仿制药行业和利益相关者之间的资源交换,来实现这一目标。
2021年5 月 19 日FDA发布了今年第二批 21 篇特定产品指南(PSG),其中包括复杂产品糠酸氟替卡松;乌美溴铵;维兰特罗吸入粉末(RLD:TRELEGY ELLIPTA)、咪 达 唑 仑鼻喷雾剂(RLD: NAYZILAM)、甲氧氯丙酰胺计量鼻喷雾剂(RLD: GIMOTI)以及静脉用美洛昔康溶液(RLD: ANJESO)的指南。从FDA的PSG指南数据库中我们可以看到,到目前为止 FDA 共发布了 1896 篇特定产品指南。
C-复杂仿制药的案例浅析
下面我们通过几组数据和案例来了解一下复杂仿制药的具体情况:
2021年初,由美国媒体The Hill 主办、普享药协会(AAM)赞助的“复杂仿制药和处方药格局”网络研讨会上,与会者在演讲资料中提到美国市场之外的复杂仿制药审批情况。具体参见下表:
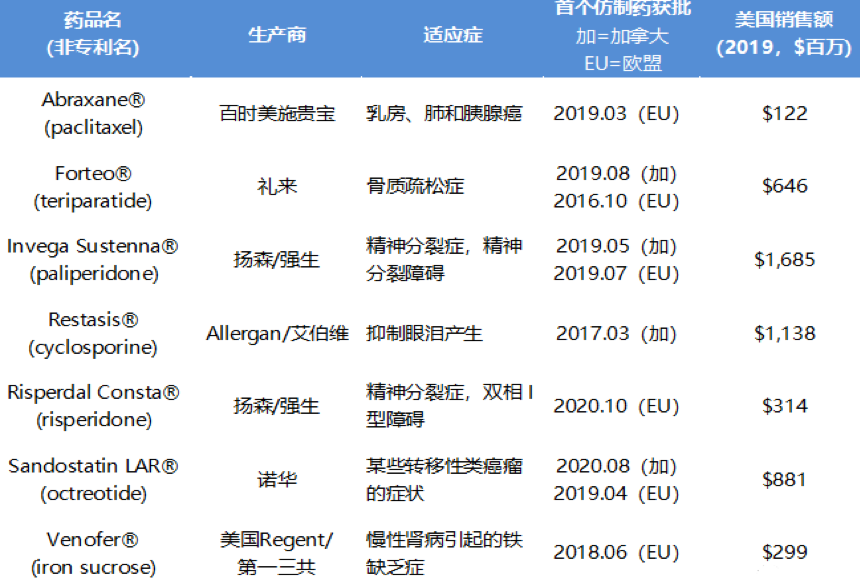
来源:识林
另外从近几年FDA仿制药办公室(OGD)发布的仿制药年报中我们可以看到,2018年FDA批准或暂时性批准了1021份新药简化申请(ANDAs),其中复杂仿制药占14%;2019年总共有1,014个仿制药获得最终批准和初步批准,在这些批准中,有110个属于复杂的仿制药,占比为10.8%。
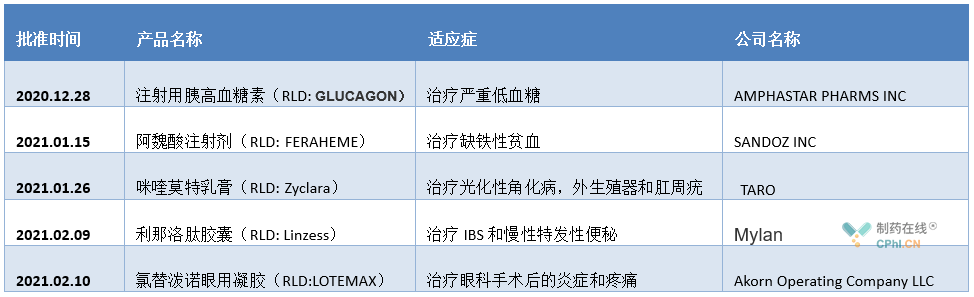
2021 财年 OGD 批准的一些值得关注的复杂仿制药有以下几种:
总结
虽然美国仿制药市场留给后来者的利润并不丰厚,但是对于复杂仿制药的仿制企业而言,现状却不是这样的。因为复杂仿制药的技术壁垒和法规难题,如果一个仿制药公司积极 致力于这些竞争不充分的领域,通过努力是可以获得较好回报的。和创新药相比而言,复杂仿制药的失败概率低很多,确实是一些企业的不错选择。希望中国企业可以抓住机会,在这个领域积极拓展,争取不断增强行业话语权。
参考资料:
1-FDA官网
2-FDA 2021 仿制药论坛上总结的审评和政策重点
3-《Alex Brill, Potential Savings from Accelerating US Approval of Complex Generics》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57