近日,根据NMPA官网显示,江苏豪森4类仿制药「盐酸鲁拉西酮片」的上市申请(受理号:CYHS2000257、258)已经变更为“在审批”状态,预计本月获批上市,为国产第 2 家获批。鲁拉西酮是一种**分裂症药物,原研已进入医保。
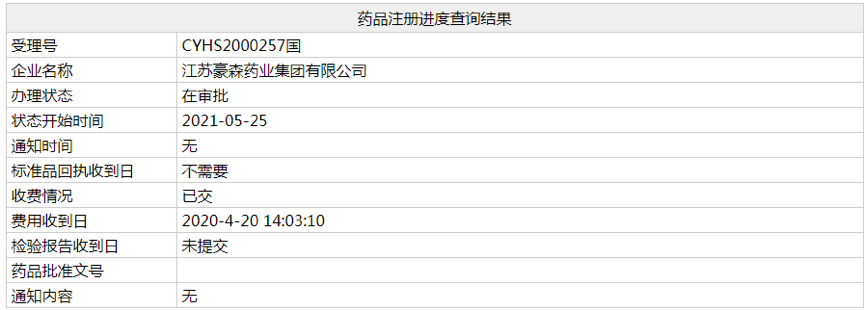
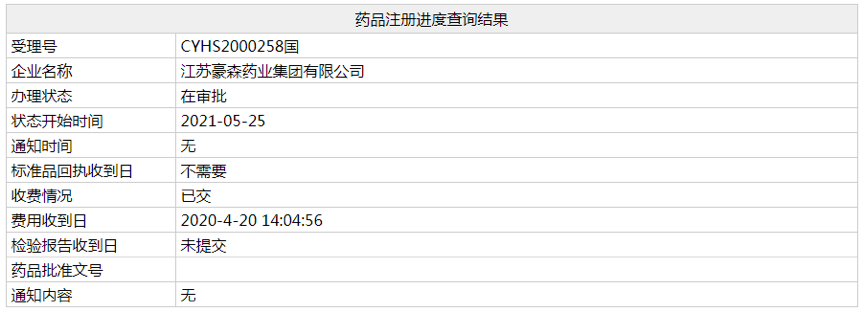
(资料来源:NMPA官网)
原研进入中国医保
原研盐酸鲁拉西酮(Urasidone HCl、商品名:Latudal/罗舒达)是住友制药研发的一款非典型(第二代)抗**病药物,为多巴胺(D2)和五羟色胺(5-HT2A、5-HT7)受体拮抗剂。
2010年10月,该药首次获得FDA批准,目前已经获批3项适应症,分别为:①治疗成人和青少年(13-17岁)**分裂症;②单药治疗成人和青少年(10-17岁)双相I型情感障碍抑郁发作;③作为锂盐或丙戊酸盐的辅助疗法,用于治疗成人双相I型情感障碍抑郁发作。2019年1月,该药在中国获批上市,用于成人**分裂症的治疗,并在2020年医保谈判中成功进入2020年国家医保。
截至2020年末,罗舒达已在全球27个国家和地区获批上市,凭借疗效、安全性、耐受性的综合特点优势,罗舒达被众多国际治疗指南推荐使用。经查询IMS数据库,盐酸鲁拉西酮片2019年全球销售额约为34.05亿美元,其中国内销售额约为5.48万美元;2020年全球销售额约为37.62亿美元,其中国内销售额约为112.29万美元。
海正拿下首仿
根据CDE官网显示,目前,共有5家企业先后递交盐酸鲁拉西酮片仿制药上市申请,其中海正药业最早递交上市申请,并于2021年4月获批上市成为首仿,用于**分裂症。除此之外,豪森和扬子江推测其还递交了针对双相I型障碍障碍的上市申请。此外,湖南洞庭药业、石家庄四药、华海药业和辰欣药业等处于BE试验阶段。
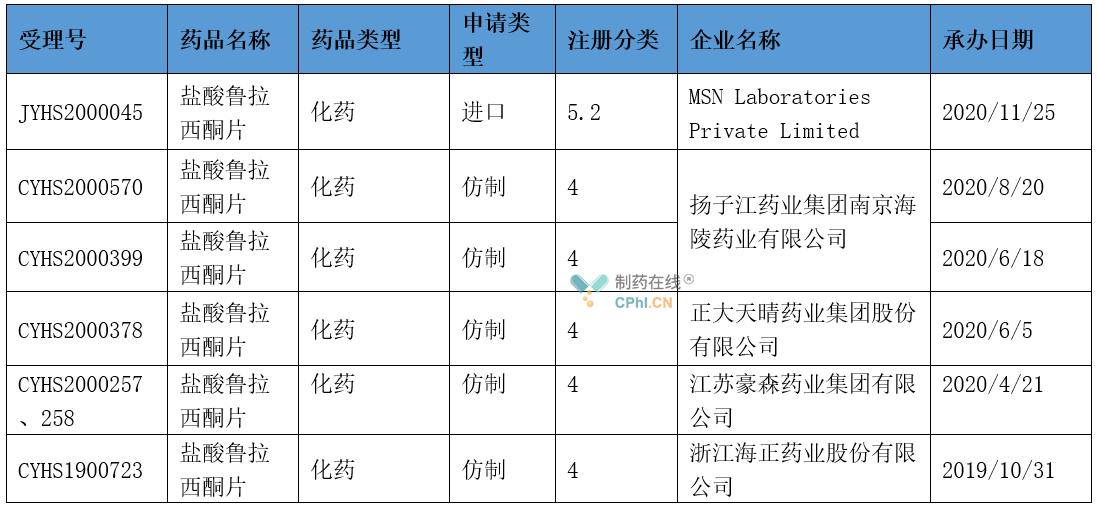
(资料来源:CDE官网)
**分裂症是复发率很高的慢性疾病,除了会伴有幻觉、妄想、言语紊乱等阳性症状以及情绪表达减少或动力缺乏等阴性症状之外,还常会伴有记忆力、注意力、执行能力低下等认知功能障碍和坐立不安、抑郁等情绪症状。随着时间的推移,各种各样的症状出现,生活和就业会变得愈发困难。据中国**卫生调查(CMHS)显示,国内**分裂症及其他**病性障碍患者数量或达一千万。
目前常用的非典型抗**病药中,大多对阳性症状的控制尚可,但并不能完全解决包括阴性症状、认知症状等在内的多维度症状。而且,部分药物容易产生体重增加,糖脂代谢异常等副作用。而盐酸鲁拉西酮的上市将会为国内患者带来更多选择。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57