近日严寒天气持续南下,覆盖中国大部分地区。在北中国和长江流域都带来飘飘瑞雪。伴随着迎接虎年带来的又一场大雪,很多省局也赶在春节前发布本省关于变更管理的相关文件。本文对于2021年度国家局和各省局发布的与变更相关的文件进行汇总和梳理,期望给制药同仁提供2022年春季中国制药行业变更管理的最新面貌。

第一部分:国家局变更大纲的核心内容再解读
要点1-MAH对变更类型要把握准
2021年1月13日发布的《药品上市后变更管理办法(试行)》是建国以来针对制药行业变更管理发布的综合性管理文件,是中国制药行业变更管理的核心大纲。在这份文件中,对于变更的分类说的很清楚:
第二条:本办法所指药品上市后变更包括注册管理事项变更和生产监管事项变更。
注册管理事项变更包括药品注册批准证明文件及其附件载明的技术内容和相应管理信息的变更,具体变更管理要求按照《药品注册管理办法》及相关技术指导原则的有关规定执行。
生产监管事项变更包括药品生产许可证载明的许可事项变更和登记事项变更,具体变更管理要求按照《药品注册管理办法》《药品生产监督管理办法》及药品生产质量管理规范的有关规定执行。
所有MAH、生产企业和各个药监省局发布的变更管理文件,都应该围绕这些变更类型来进行规定和描述。但是我们不得不遗憾的看到,有些省级药监局到现在都没有明白这一条的含义,在自己发布的变更沟通文件和变更备案文件中,自己硬造出一些分类,把变更问题搞得更复杂。
然而,对于一个MAH,所面临的变更类型还不仅仅是上面这两种变更,还有一种变更属于质量体系类变更。因此,一个MAH的变更管理文件应该针对三类变更进行规定和描述:注册管理事项变更+生产监管事项变更+质量体系类变更。
要点2-历史问题被放过是有原则的
2021年1月13日发布的《药品上市后变更管理办法(试行)》的第23条闪烁着人性的光芒,让这份文件显得很有价值。
第二十三条:新修订《药品管理法》和《药品注册管理办法》实施前,持有人或生产企业按照原生产工艺变更管理的有关规定和技术要求经研究、验证证明不影响药品质量的已实施的变更,或经过批准、再注册中已确认的工艺,不需按照新的变更管理规定及技术要求重新申报,再次发生变更的,应当按现行变更管理规定和技术要求执行,并纳入药品品种档案。
但是各位MAH千万不要对这条的有效性认为是无限制条件的。如果第23条可以发挥作用,必须满足2点:
MAH所销售药品满足最新法定标准(中国药典现行版和各类补充技术规定);言外之意,市场上药品抽检结果必须合格。
MAH必须保证自己销售的药品是安全的。
要点3-同一批文多种工艺的情况会越来越多
我们梳理《药品上市后变更管理办法(试行)》会发现,在两类重要变更中,官方都强调变更前后的药品要保持一致性。
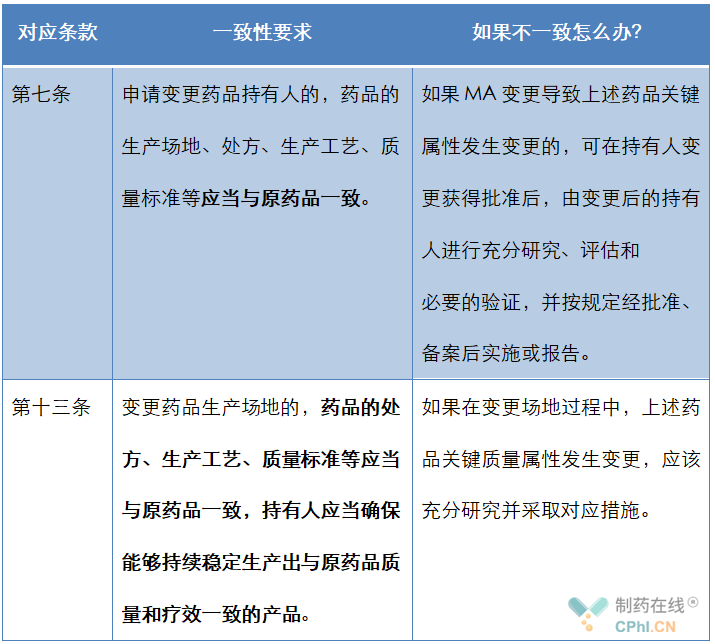
从上面表格内容可以看出,MAH对变更前后药品关键属性不变是一种追求和期望;而如果在上述变更过程中,由于MAH变更或者生产场地变更导致关键属性(处方+工艺+质量标准等)发生变更,那么MAH必须承担研究这些变更影响的主体责任。
从上面法规条文和现实情况看,生产场地变更会导致药品关键属性(处方+工艺+质量标准等)发生变更;这些情形当被官方批准/备案/认可年报以后,就会导致一种局面出现,同一个药品批文下会存在多种生产工艺、多种处方和质量标准。
很多制药同仁对这种情况不能接受,而这是现实存在的。同一个药品批文下可以合法合理存在多种生产工艺、多种处方和质量标准,基础是被证明在人体内具有相同的治疗效果。而这才是一致性评价的真正含义。
第二部分:各省局变更管理文件的年度大结局
通过梳理,目前各省针对本省药品变更管理的文件主要分为两类:变更沟通交流管理文件+变更备案管理文件。本部分内容分两部分来梳理。
A-各省变更沟通交流管理文件情况梳理
说明:本表信息截止到2022年1月25日,以各省最后发布信息为准。
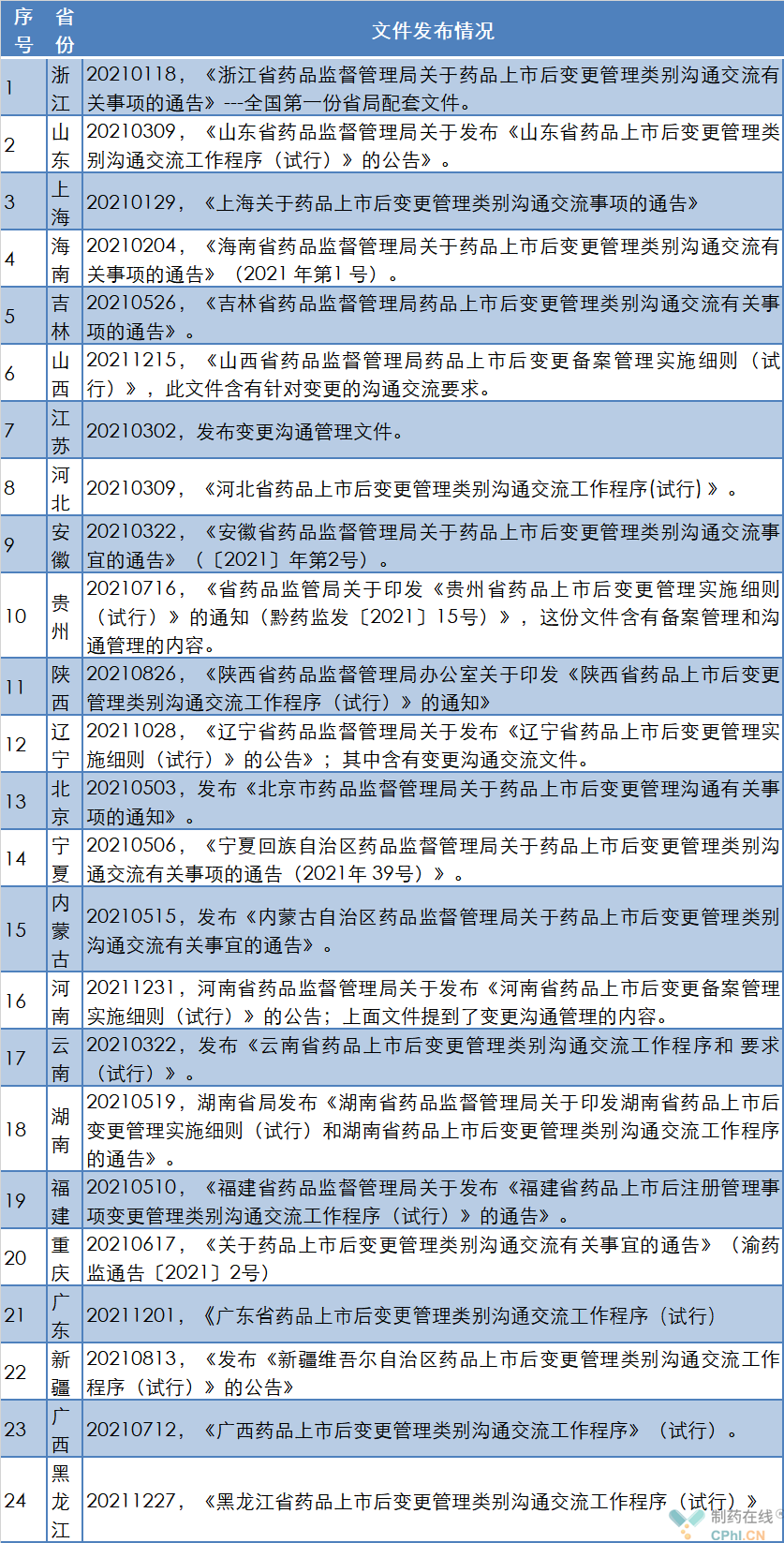
说明:上面信息如果遗漏,敬请海涵。
B-各省变更备案管理文件情况梳理

说明:上面信息如果遗漏,敬请海涵。
第三部分:各省局文件质量各异,体现了对国家局文件理解存在偏差
这里面,部分省局尽管配套文件发布时间较早,但是存在不合理规定,说明某些省局对国家局文件学习不透,理解存在偏差。
河北省局对于药品生产场地变更的部分规定不合理
例如,在(四)药品生产场地变更管理章节提到的如下内容,应该是不需要的。
(1)新旧生产场地所涉及品种的处方、生产工艺、批量、原辅料、溶剂、包装材料和/或容器、质量控制等保持一致的,根据现行技术指导原则开展研究后,在国家药品监督管理局药品业务应用系统提交相关品规的药学研究资料。
(2)场地变更的同时发生一或多项关联变更,所涉及的关联变更均为微小变更的,根据现行技术指导原则开展研究后,在国家药品监督管理局药品业务应用系统提交相关品规的生产场地变更药学研究资料,并将所涉及微小变更事项集中在年度报告中提交。
分析:试问如果一个MAH或者受托生产企业,如果发生药品生产场地变更,但是这个生产场地变更对于药品处方、工艺、质量标准等事项几乎无影响,或者影响属于微小变更,为什么需要向国家局业务系统提交药学资料?这种情况只需要变更生产许可证即可。
山西省文件部分内容描述不合适
例子1:第六条 变更药品生产场地,包括下列情形:
(一)境内持有人或药品生产企业内部变更药品生产场地;
(二)同一生产地址内的生产场地的新建、改建、扩建;
(三)生产地址的改变或新增;
(四)境内持有人变更生产企业(包括变更受托生产企业、增加受托生产企业、持有人自行生产变更为委托生产、委托生产变更为自行生产)。
分析:上面变更情形描述的(三)和(四)是重复的,出现这种情况的原因,是委托生产这一管理事项还存在于部分省局历史记忆中,不习惯于采用生产地址变更来管理。
例子2:部分内容错误
第十五条 变更药品生产场地时,药品的处方、生产工艺、质量标准等注册管理事项一并发生一项或多项中等变更的,持有人可先行按照本细则第九条规定提出注册管理事项变更备案。备案完成后,持有人按照本细则第十条规定提出药品生产场地变更申请。
注册管理事项变更备案确因实际情况无法在药品生产场地变更申请提出前完成的,应充分说明理由,并参照本细则第十四条第二款规定办理。
解析:上面描述提到的第十四条第二款属于文字错误,因为第十四条没有分为不同小款,因此,应该指的是:第十条第二款。
海南省局所发布问答的部分信息描述不合理
2021年9月,海南省局发布《药品上市后变更备案相关共性问题(一)》。其中,部分问答描述信息存在争议。
问题12.某化药特殊剂型制剂,拟通过总混增大批量,总混前制备工艺保持不变,是否可以判定为中等变更??
答:根据《已上市化学药品药学变更研究技术指导原则(试行)》,化药特殊剂型制剂增大批量属于重大变更,是基于产品特点和工艺复杂程度确定的,与增大批量的方法无关。
解析:海南省局上述问答不是很全面,工作思路偏保守和机械。化药特殊剂型的扩大批量(包括缩小批量)是比较复杂的问题,需要慎重对待,全面研究,这肯定无疑问。但是,如果企业的疑问就是问题中所描述的,企业扩大批量不是通过改变总混前的制备工艺来改变,而是通过在总混这一工序扩大批量。是可以根据具体变更情形进行讨论的,而不是一刀切的都认为属于重大变更。
企业如果提供全面和充分的证据,总混前各个小批次测试的关键属性可以拿到,总混后(扩大批量后)的性质也进行了全面测试;如果数据可以证明变更前后无明显变化,这个变更是可以认定为属于中等变更的。类似操作在连续制造(CM)指南中也提到,属于行业常规认识。
2021年末,江苏省局发布的变更实施案例也有类似情形;江苏省局和企业充分沟通,确认可以按照中等变更备案。
除了上面提到的这些省局文件的不足情况外,一些省局积极探索,不断查漏补缺,也是值得表扬的;例如下面所列举的例子。
云南省局发现不足,及时修订
云南省局发布的涉及变更文件不仅采用了详细的文字描述,还提供了流程图。到目前为止,云南省局针对情况变化,第一个修订已经发布文件的省局。值得表扬。
山西省局弥补过去管理文件的不足
在2020年末实施《中国药典》2020版时,山西省局没有发布相关配套实施文件。在这次发布变更管理配套文件时,增加了相关内容。
第三十三条 新版《中国药典》或新修订标准实施过程中,如涉及处方、工艺和原辅料来源等变更的,应按照《药品注册管理办法》及相关变更研究技术指导原则和药品生产质量管理规范等要求进行充分研究和验证,按相应变更类别批准、备案后实施或报告。
对于仅涉及药品说明书和标签中【执行标准】项下内容修订的以下两种情形,持有人按国家局关于药品说明书和标签管理规定的相关要求自行调整说明书、标签中【执行标准】项内容,企业执行日期以企业内部质量管理记录载明的日期为准,并在年度报告中予以报告。
(一)仅执行《中国药典》的品种,且修订后仅执行新版《中国药典》;
(二)同时执行《中国药典》和药品注册标准的品种,且修订后同时执行新版《中国药典》和新修订药品注册标准。
第四部分:2022年度药企变更会顺畅开展吗?
牛去虎来春萌动,无限生机待开拓。在国家局和各省局积极努力和推动下,中国制药行业变更工作总算在逐步走上正轨。笔者认为,在2022年度,如果要想让中国药企各类变更顺利开展,还需要从如下几个方面努力:
第一、和变更相关配套的技术文件还要加快出台,更好的完善这个变更研究支持体系。例如2022年初,中国医药包装协会发布的针对包材等同性/替代性研究标准的发布,就是很有意义的一件事。
第二、国家局文件中的另行规定涉及的内容,还需要尽快明确化。针对进口药品生产地址从境外变为境内的操作文件,还需要尽快出台,这样才能促进医药产业加快回流。
第三、各省局应该加快修订自己发布的文件。随着这些文件的实施和应用,不足和错误会逐步被发现,希望各省局多学习云南省局的做法,加快修订。
第四、也是最后一条,希望各省局技术审评人员,在面对复杂变更时,不畏难,不推脱,积极研究和思考,从变更本身和企业实际情况出发,积极探索,为企业加快发展而努力。
参考文献
1-NMPA官网信息
2-各省局官网信息
3-CPHI《各省变更管理文件最细进展巡礼》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57