美国FDA作为全球最关键医药市场的监管方,其一举一动都被行业所关注。每年初FDA会发布本年度法规指南起草和修订工作计划,也是行业人士来推测行业法规进展的一份关键文件。2022年1月初,FDA先后发布《Guidance Agenda: Guidance Documents CBER is Planning to Publish During Calendar Year 2022》和《CDER Guidance Agenda-New & Revised Draft Guidance Documents Planned for Publication in Calendar Year 2022》。
本文结合行业发展态势,对这两份文件进行梳理和解读,希望可以为中国制药行业提供借鉴。
第一部分:2022年度生物制品指南工作计划解析
A-生物制品指南工作计划总体情况
2022年度生物制品指南工作计划共涵盖三个分类,FDA拟在2022年发布14个指南。具体情况参见下表:

B-关键指南影响分析
这部分将讨论对于制药行业影响明显的几个关键指南。
采集血小板的自动化方法指南
根据FDA工作计划,2022年FDA将发布《Collection of Platelets by Automated Methods》;在这个指南里面,将详细介绍如果使用现代化仪器进行血小板的收集。针对血小板采集方法的调整,工艺验证要求也会调整。因此,2022年,FDA将发布一个指南,介绍工艺验证中取样计划的统计学要求。
针对含有基因编辑的基因治疗产品的新指南
根据FDA工作计划,2022年FDA将发布《Considerations for the Development of Human Gene Therapy Products Incorporating Genome Editing》。在这个指南里面,针对某些基因治疗产品会含有基因编辑编辑操作,FDA会提出自己的新技术要求,也为行业的监管探索开辟了新的参考。
CAR-T产品开发注意事项指南
随着世界各国大型制药公司热衷于开发细胞治疗产品,CAR-T开发热潮不断。针对这个局面,2022年FDA将发布指南《Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Therapies》,为行业建立针对CAR-T产品监管的新标尺。
第二部分:2022年度药品指南工作计划解析
A-药品指南工作计划总体情况
2022年度药品指南工作计划共涵盖17个分类,FDA拟在2022年发布98个指南。具体情况参见下表:
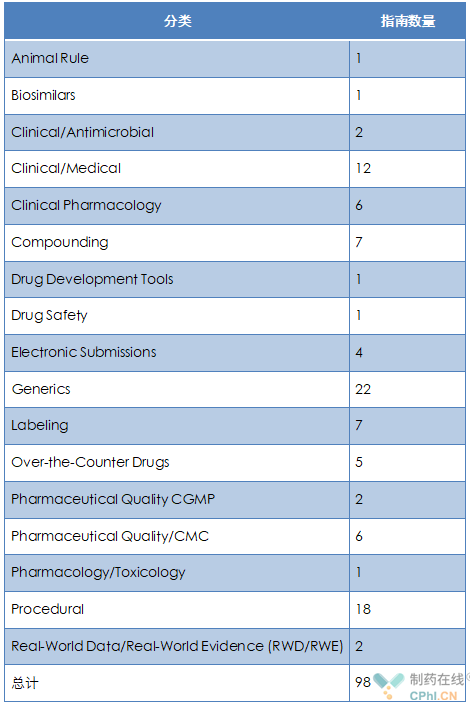
从上面表格可以看出,这98个指南主要集中于几个热点分类,分别是:临床医学、仿制药、标签管理、CMC领域和规程分类。
B-关键指南影响分析
针对制药行业关注的热点话题和指南,下面分析介绍一下:
Product Class-Specific Recommendations for Developing Biosimilar and Interchangeable Biological Products
在欧盟和中国生物类似药/生物制品的分类中,没有Interchangeable这个分类。一旦生物类似药或者其他生物制品被欧盟或者中国药政当局批准,可以直接替换已上市的参比生物制品。但是在FDA法规体系中,考虑到生物制品属于大分子生物制品的复杂性,已经获得批准的生物制品并不能直接替换已上市同类生物制品。需要被证明具有可互换性,才能在临床上替换其他同类生物制品。这个指南对于协助行业认识生物制品的复杂性,以及建立可比性具有重要意义。
ANDA and NDA Submissions: Data Integrity for BA/BE Studies at Testing Sites
随着印度semle案件和其他类似案件的调查和查处,欧美药政当局越来越关注境外临床试验数据的合规性。2021年12月20日发布的中国境内核查管理规定,也将境外BE基地数据的合规性作为高风险因素之一。这个指南将促进针对BA/BE研究的数据管理。
Refuse-to-Receive指南
在过去几年,FDA为了提高申报质量,发布了多个针对药品申报的RTR指南(拒绝接受指南)。在2022年工作计划中,又列入2个指南,分别是《ANDA Submissions – Refuse-to-Receive for DMF Facilities Deficiencies》和《ANDA Submissions – Refuse-to-Receive Standards: Questions and Answers》。可以预见,这些指南对于中国药政当局审评要求也会起到促进作用。
Evaluation of Therapeutic Equivalence
国内关于一致性评价的文件名称是错误的,不是质量和疗效一致性评价,应该就是疗效一致性评价。这个一致性指的是治疗效果,不包含处方、工艺、包材和质量标准。2022年1月份,中国药典委发布了氯化钾缓释片的质量标准征集意见稿;其中针对溶出度,包含了6个分析方法。从这一点可以看出,中国药典水平也提升到了21世纪初的水平了。FDA发布《Evaluation of Therapeutic Equivalence》指南,将会深化行业对仿制药一致性的深刻认识。
Q1Q2Q3指南
FDA将在2022年发布《Physico-Structural (Q3) Characterization of Topical Dermatological Drug Products Submitted in ANDAs》,这将是FDA发布的第一个详细介绍Q3要求的指南,必将对复杂仿制药、复杂注射剂的开发提供支持。这个指南在2021年度也列入了计划,但是可能是比较困难的技术话题,因此拖延到2022年来完成。
共线评估新要求
2022年,FDA将修订《Non-Penicillin Beta-Lactam Drugs: A CGMP Framework for Preventing Cross-Contamination》,这是FDA对这个涉及共线评估指南的第一次修订,必将对国际制药行业控制交叉污染的策略产生更大影响。
Stability Considerations for Drug Substances and Drug Products in NDAs, ANDAs, and BLAs and Associated Labeling Statements for Drug Products
ICH针对稳定性的指南集中在Q1部分,由于发布时间久远,有些落后了。虽然FDA在总体原则上,采用ICH指南,但是FDA也会针对行业发展,提出自己的要求。这份指南应该是FDA对药品稳定性的最新要求。
总结
综合上面信息,可以看出2022年FDA工作指南的一些技术特点:
第一.紧扣时代脉搏,回应行业需求。例如行业对于基因治疗和细胞治疗的开发热度很高,因此FDA就组织专家团队来研发相关指南,促进类似问题的解决。
第二.为了降低医保费用,为仿制药公司提供更多智力支持。从2022年FDA药品指南工作计划中,可以看出仿制药分类占比最高。
第三.针对一些行业热点,例如疗效一致性、BE数据完整性、交叉污染控制,FDA都会根据行业需求来确定自己的工作方向。
参考文献
1-FDA官网信息
2-CPHI《FDA发布2021年度指南工作计划,引领法规发展新动向》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57