新冠(SARS-COV-2)疫情自爆发以来,肆虐全球,蔓延多时,虽然各国已批准多种**上市,并开始大规模接种,然而因为病毒变异及**保护效力的原因,接种**后感染并不鲜见,时至今日疫情形势依然严峻。
回顾百年流感历史(1918-2020),真正让人类社会免于流感影响的手段正是:流感**+口服特 效药的"防+治"组合。新冠病毒同样作为呼吸道传染病, 新冠**+口服抗新冠药同理有望成为终结疫情影响重要一环,抗新冠药物有望成为终结疫情的最后一块拼图。
事实上,从疫情爆发初期的2020年1至3月,即已有多家药企开始投入新冠治疗药物的研发。目前进度比较快的主要分为两种:中和抗体与小分子抗病毒 药物。中和抗体药物的成本与定价较高,还需要静脉注射,因此普及受到较大限制。与中和抗体药物相比,小分子抗病毒 药物成本较小,价格也相对低,不少在研剂型为口服,更有利于大规模推广,成为新冠研发下半场的热点领域。
目前,全球范围内获批的新冠治疗口服药物包括默沙东的Molnupiravir、辉瑞的Paxlovid,以及礼来的Baricitinib。
其中Baricitinib于2021年7月获FDA紧急使用授权,可单药治疗新冠住院患者。不过,Baricitinib属于"老药新用",疗效存在争议。辉瑞的Paxlovid作为全球首 款针对新冠病毒的口服3CL蛋白酶(3C-like protease)抑制剂,于2021年12月获FDA紧急授权,其III期临床研究结果显示,轻中度新冠患者在确诊三天内服用该药,其住院或死亡风险可降低约89%。Paxlovid的表现可以媲美新冠中和抗体的治疗效果,也显著优于默沙东的Molnupiravir(50%)。这一消息引起了人们的广泛关注,3CL蛋白酶也开始进入大家的视野。
新冠病毒复制的关键--3CL蛋白酶
新冠病毒是一种具有包膜的单正链RNA病毒,在进入宿主细胞后,它会分解释放出病毒RNA,病毒RNA借由宿主细胞中的核糖体翻译成为两条多聚蛋白pp1a和pp1ab,这两条多聚蛋白就像是整盒包装的拼图,还不能发挥作用,需要在3CL蛋白酶和PL蛋白酶作用下拆装再重组,以形成具有功能的结构蛋白。在这个过程中,3CL蛋白酶负责多聚蛋白11个位点的切割,以产生对病毒生存、繁殖非常重要的结构蛋白,因此又被称为主蛋白酶。3CL蛋白酶抑制剂可以抑制3CL蛋白酶的活性,从而干扰病毒复制过程,达到抗病毒的效果。
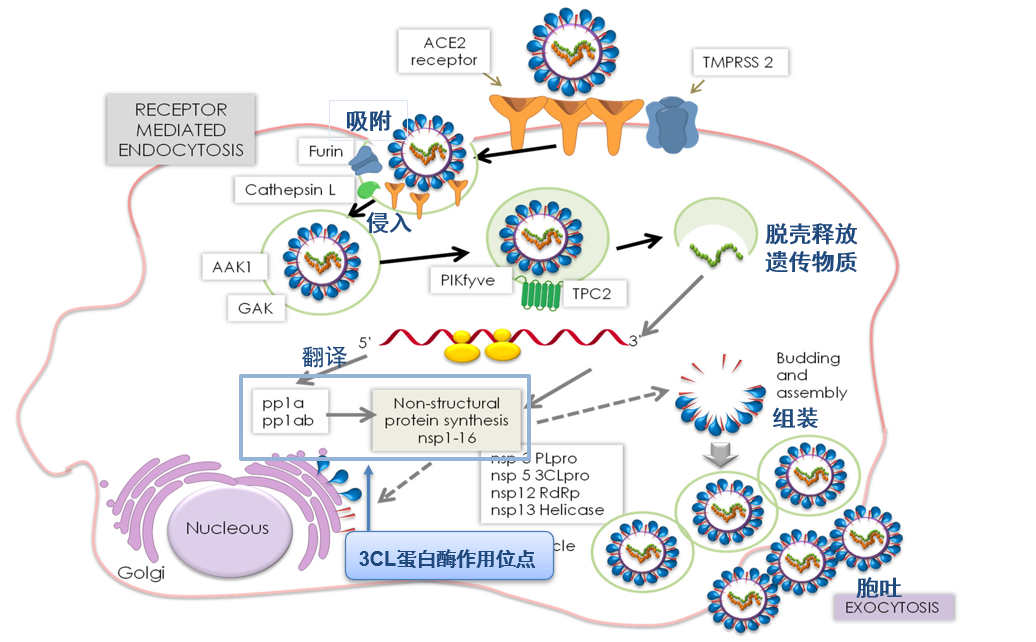
新冠病毒感染宿主细胞循环示意图(来源:参考2)
而且3CL蛋白酶在不同属冠状病毒间高度保守,在人体内没有同源蛋白,这意味着将其作为药物靶点进行抑制剂设计,可以达到较好的选择性与安全性预期。
辉瑞3CL蛋白酶抑制剂--Paxlovid
Paxlovid是由3CL蛋白酶抑制剂PF-07321332 与低剂量 Ritonavir(利托那韦)组成的复方制剂。PF-07321332旨在阻止新冠病毒的繁殖,而Ritonavir则减缓PF-07321332在体内的分解,以使其在体内保持较长时间和较高浓度的活性,帮助对抗病毒。
值得一提的是,PF-07321332的研发早在2002年SARS-CoV爆发的时候就开始了。在SARS-CoV流行时期,辉瑞的研发团队曾试图以 Rupintrivir(人鼻病毒 3C 蛋白酶的不可逆抑制剂)为起点,设计 SARS-CoV 的 3CL 蛋白酶抑制剂。在经过了一系列优化后,得到了 PF-00835231。
然而,当年有初步成果后,甚至还没来得及动物实验,这款药物就因SARS-CoV疫情消亡而失去了用武之地,从此被搁置。直到 2020 年新冠疫情爆发,研究发现,新冠病毒和 SARS-CoV 复制所需的 3CL 蛋白酶的序列在蛋白质切割的催化位点100%相同,辉瑞这才把差点被埋没了的 PF-00835231翻出来继续开发。PF-00835231的活性好且代谢稳定,但渗透性和口服吸收利用度却很低。因此,辉瑞研究团队在前一化合物的基础上经过进一步优化,得到了 PF-07321332。
进一步研究发现,PF-07321332的多个位点会被肝微粒体中的CYP3A4(细胞色素P450 3A4酶)氧化代谢,即CYP3A4对PF-07321332代谢的影响至关重要。因此,研究人员使用CYP3A4的抑制剂Ritonavir作为共同给药,来改善PF-07321332的治疗效果。Ritonavir能使CYP3A4失活,减小主要抗病毒 药物的代谢清除率,改善药物的生物利用度与药代动力学。这一策略也是借鉴了以往的抗病毒 药物给药策略。至此,Paxlovid (PF-07321332+Ritonavir) 正式诞生。
辉瑞公司对Paxlovid进行的临床试验包括来自北美和南美、欧洲、非洲和亚洲的临床试验地点的1219名成年人。试验参与者有老年人或有潜在健康风险的患者,这增加了出现重症的风险。参与者按1:1的比例随机分配接受Paxlovid或安慰剂治疗,共服用5天,在出现症状后3天内开始治疗。
结果显示:在出现症状后3天内开始治疗的患者中,Paxlovid组与安慰剂组相比,住院和死亡风险降低了 89%。在出现症状后5天内接受Paxlovid治疗的患者,住院或死亡风险与接受安慰剂相比降低了88%。
65 岁或以上患者是住院或死亡风险最 高的人群之一,Paxlovid对此类患者的相对风险降低率为 94%。
在研究进行的第 5 天,对 499名患者进行的病毒载量测试显示,Paxlovid 相对于安慰剂将病毒载量降低了约10倍,表明其对新冠病毒具有强大的活性,并且是迄今为止报告的口服新冠药物中,病毒载量下降幅度最 大的。
基于优异的临床试验数据,2021年12月22日,Paxlovid获FDA紧急批准,2022年2月11日,获NMPA附条件批准进口注册,Paxlovid的获批上市之路从美国到中国仅用了50天,开创了史上最快的新冠药物进口纪录。
而且在3月16日发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》中,将Paxlovid纳入了抗病毒治疗方案。
3CL蛋白酶抑制剂研发格局
有了辉瑞的"代言"后,3CL蛋白酶已成为抗新冠口服药物中最火热的靶标,也吸引了国内外企业纷纷布局。
盐野义--S-217622
S-217622是盐野义通过高通量筛选获得的一款口服3CL蛋白酶抑制剂。动物实验表明,S-217622在大鼠、猴子及狗中口服给药均具有高吸收率及低清除率(CL),在猴子和狗中的半衰期(t1/2) 长,分别约为10和30小时。这些结果表明S-217622可能用于每日一次口服治疗新冠病毒,而不需要利托那韦作为增强剂。
不久前盐野义公布了S-217622的IIb期试验结果,这是一项随机、安慰剂对照、双盲研究,入组428名新冠感染的轻度/中症受试者(日本419人,韩国9人),且主要在疫情Omicron变异株感染患者中进行,主要目的是确认S-217622口服给药5天后的抗病毒效果和临床症状改善情况。
结果显示:抗病毒作用:在两种剂量下,与安慰剂组相比,S-217622组在第4天(第3剂后)在以下各项方面均显示出显著差异:1)快速降低病毒滴度(达到主要终点);2)病毒滴度阳性的受试者比例,在S-217622治疗组中低于10%,相比IIa期中较安慰剂组降低幅度更大。
临床症状改善:从开始给药(Day 1)到120小时(Day 6),12种新冠症状总分有改善倾向。两个剂量组中的呼吸系统症状总分(鼻塞或流鼻涕、喉咙痛、咳嗽、呼吸急促)有显著改善效果。
由于其良好的药代性质,有望实现新冠的单药治疗,摆脱辉瑞Paxlovid对于Ritonavir的依赖。目前盐野义已在日本提交上市申请,同时也在与FDA和EMA沟通,并计划开展全球III期临床试验。
Pardes Biosciences--PBI-0451
PBI-0451是Pardes Biosciences公司开发的一款口服3CL蛋白酶抑制剂。Pardes Biosciences是一家仅成立2年的公司(2020年2月成立),目标是以基于结构的药物设计和可逆的共价修饰调节化学平台开发抗病毒 药物,致力于解决世界上最紧迫的公共卫生挑战难题。
临床前研究显示,PBI-0451具有良好的口服生物利用度,并且耐受性良好。其I期临床试验于2021年6月在新西兰开展,计划招募120名受试者,临床给药方案中除4个不同剂量的PBI-0451单药给药外,还包含了Ritonavir和咪 达 唑 仑(**)两个P450酶抑制剂分别与PBI-0451的组合给药方案。
聚焦国内
前沿生物--FB2001
FB2001由前沿生物和中国科学院上海药物研究所共同研发。目前,FB2001已获得FDA核准签发的临床试验批件,并在美国启动了 FB2001 的 I 期临床试验,采用单中心、随机、盲法、对照设计,主要目的为评价本品在人体的耐受性、安全性和药代动力学特征。
截至 2021 年 4 月 28 日,受试者已经入组,并完成第一剂量组给药,经独立数据安全委员会研究,第一剂量组安全性良好,建议继续开展剂量递增研究。
君实生物/旺山旺水--VV993
VV993由中国科学院上海药物研究所和中国科学院武汉病毒研究所共同研发,由君实生物和旺山旺水合作共同承担VV993在全球除乌兹别克斯坦、吉尔吉斯斯坦、哈萨克斯坦、土库曼斯坦、塔吉克斯坦(中亚五国)外的国家或地区范围内的研究、生产及商业化工作。在小鼠模型中,VV993不仅可以有效降低病毒复制,还能显著改善由新冠病毒感染造成的肺部病理改变。其它成药性方面,VV993安全性较好,目前没有发现心脏**和神经**作用。综合目前研究结果显示,VV993是安全、可口服、动物模型上有效的抗新冠病毒候选化合物,具有重要的开发价值。
先声药业--SIM0417
SIM0417由先声药业和中国科学院上海药物研究所合作研发,在临床前动物模型上显示了良好的抗病毒活性和安全性。
此外国内还有众生睿创研发的RAY003以及广生中霖和药明康德合作研发的GST-HG171、众生药业的RAY003/004、云顶新耀的EDDC-2214以及盟科医药的MRX-18等均处于临床前研究阶段,有望在未来6个月陆续进入临床。
全球首 个新冠口服抗病毒 药物莫努匹韦(Molnupiravir)的上市,标志着新冠研发战争进入下半场。如今,全球有多款小分子口服抗病毒 药物正在研发中。3CL蛋白酶以其独特的作用机制和可成药性,成为各大药企追逐的热点。截至目前,全球范围内有望上市的3CL蛋白酶抑制剂并不多。除了辉瑞的Paxlovid已获批外,进展最快的只有日本盐野义的S-217622。从这个角度看,留给3CL蛋白酶抑制剂后来者的机会并不小,赛道值得跟进。
参考资料:
1.Coronavirus (COVID-19) Update: FDA Authorizes First Oral Antiviral for Treatment of COVID-19, Retrieved December 22, 2021, from https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-first-oral-antiviral-treatment-covid-19;
2.Gil C, Ginex T, Maestro I, et al. COVID-19: Drug Targets and Potential Treatments. J Med Chem. 2020;63(21):12359-12386. doi:10.1021/acs.jmedchem.0c00606.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57