
在国务院发布44号文(2015年)、加入ICH(2017年)、新《药品管理法》颁布(2019年)等新政保障下,港交所18A和科创板等资本加持下,我国创新药研发得以快速发展。如今,中国创新药进入“出海”爆发期。
历史数据
近年来,中国药企通过License-out将创新药权益授权给海外药企的交易不断增多,这意味着海外药企对我国新药研发能力的肯定,License-out项目的数量及金额也成为了衡量中国创新药出海战绩的直观标尺。
1.License-out项目数量
2007年3月6日,微芯生物将西达本胺海外权益以2800万美元转让给沪亚生物,实现了中国创新药出海“零的突破”。
截至2022年6月6日,中国创新药license-out项目共77个。从2019年开始,数量逐年增加,2021年达到惊人的28个。
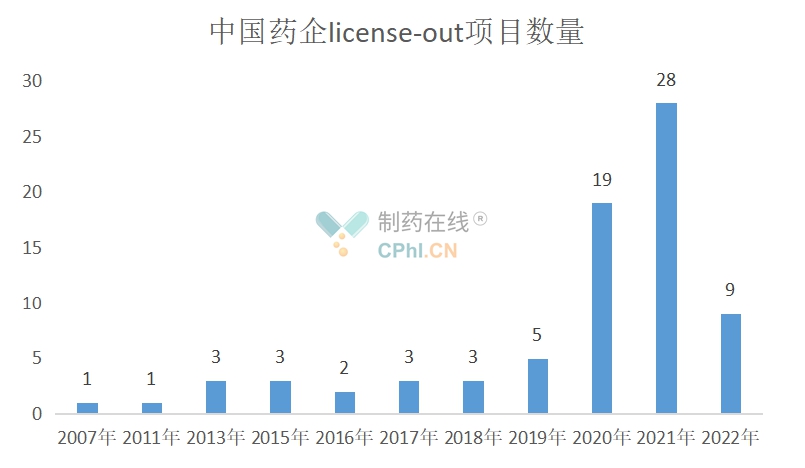
(根据公开资料整理)
2.License-out项目交易总额
从披露数据来看,2007-2022年license-out项目交易总额约有308亿美元,可以说,license-out对国内药企,尤其是新兴Biotech缓解现金流压力起到重要作用。
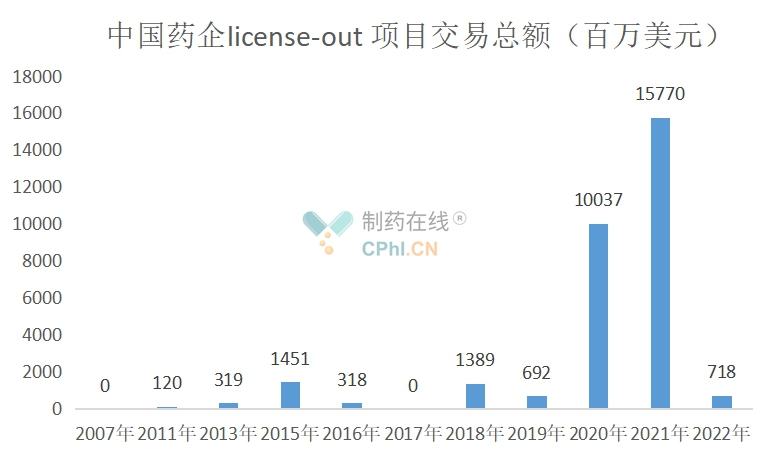
(根据公开资料整理)
3.License-out项目首付款
2007-2022年统计到的首付款总额约为32亿美元。
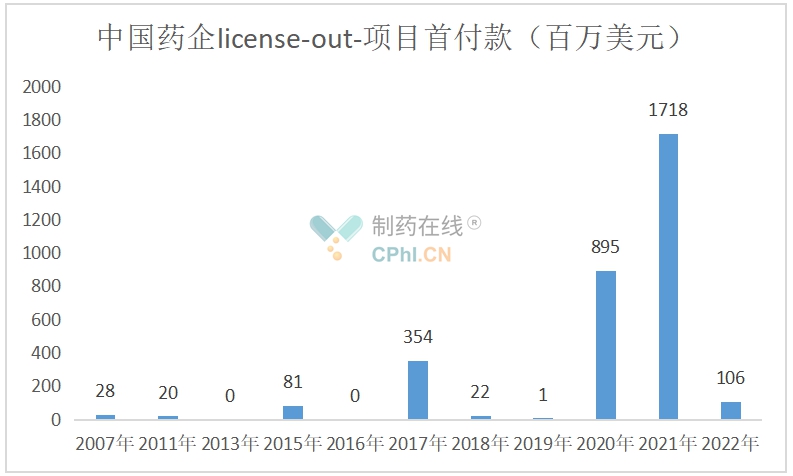
(根据公开资料整理)
多维度分析
1.美国是授权金额最高的地区
美国作为全球药物创新的领头羊,据BCG分析,2021年,美国占了全球创新药市场的一半以上(55%)。从中国药企license-out项目来看,美国也是授权数量最多、金额最高的地区,获美国药企青睐更是中国药企证明自己实力的有力证据。
77个license-out项目中,授权地区包含美国且仍在推进中的项目有39个,其余地区授权项目38项,授权美国数量占比超过半数。从2020年开始,这一数字急剧上升,2021年,中国license-out项目授权美国地区多达17个。
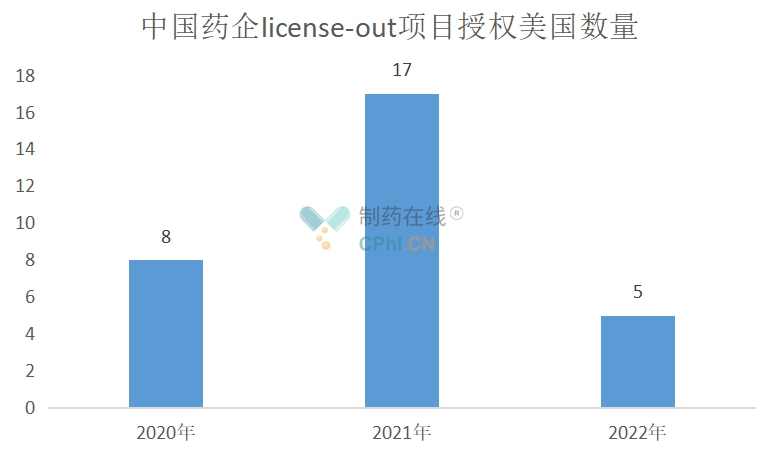
(根据公开资料整理)
77个license-out项目中,授权美国项目交易总额225亿美元,其他地区83亿美元,美国占比73%。2021年授权美国交易总额约为141亿美元,目前是历史之最。
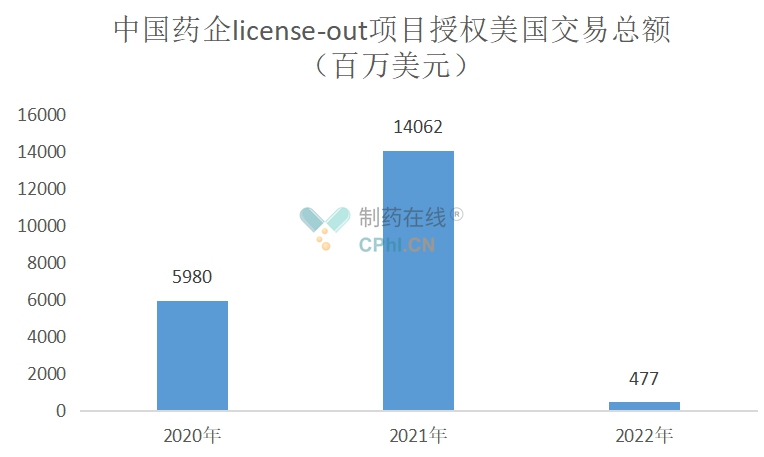
(根据公开资料整理)
授权美国项目首付款约26亿美元,占比82%。
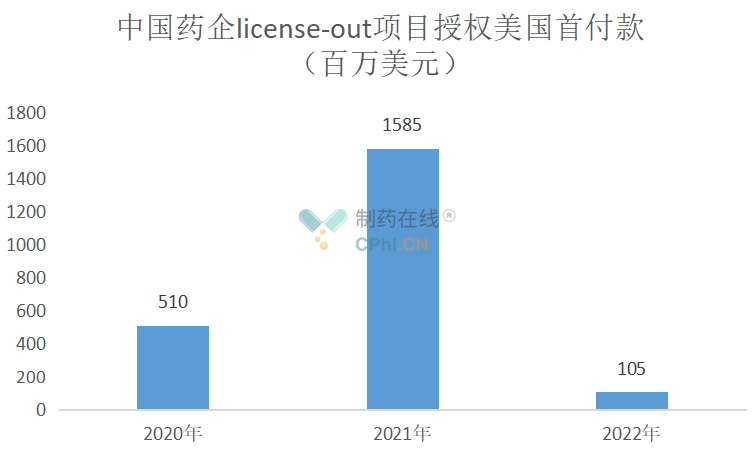
(根据公开资料整理)
2.临床价值决定交易额
License-out项目绝大多数是“首付款+里程碑付款+销售分成”的分阶段付款形式,首付款金额很大程度上代表着license-out项目的临床价值。
2007年到2022年间,首付款超过1亿美元的项目有8个。
首付款超过1亿美元的license-out项目
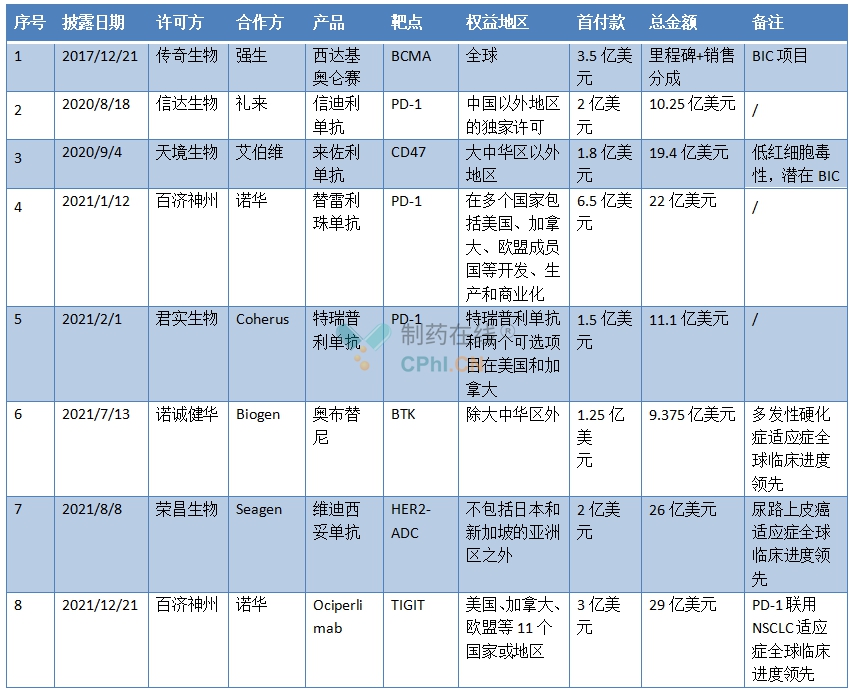
(根据公开资料整理)
细看这8个license-out项目,可以看出,这些项目要么是PD-1这个免疫疗法大热靶点,要么具备成为“best-in-class”药物潜力,要么在某一适应症上全球临床进度领 先。
例如,传奇生物的西达基奥仑赛在I期临床阶段即显示出高ORR水平,属于best-in-class产品。而荣昌生物HER2-ADC维迪西妥单抗在尿路上皮癌适应症上临床进度全球领 先。
3.早期创新药项目逐渐受到青睐
统计34个授权美国项目中,授权时在临床前试验阶段的有16个,I期临床阶段的项目7个,II期临床阶段的项目5个,III期临床阶段的项目3个,已上市阶段的项目III个。从发生交易所处的研发阶段来看,早期项目(临床前+I期临床)逐年增加。
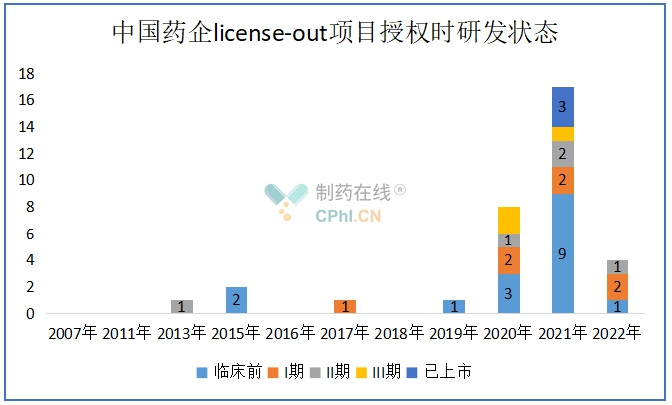
(根据公开资料整理)
近几年,临床前项目逐渐受到青睐,尤其到2021年,临床前项目有9个。可以看出,临床前项目首付款金额相对来说不大,但是都是有潜力的一些项目。例如,FibroGen就是看中CCR8项目和HFB1011在肿瘤免疫领域的潜力。
授权时在临床前试验阶段的license-out项目
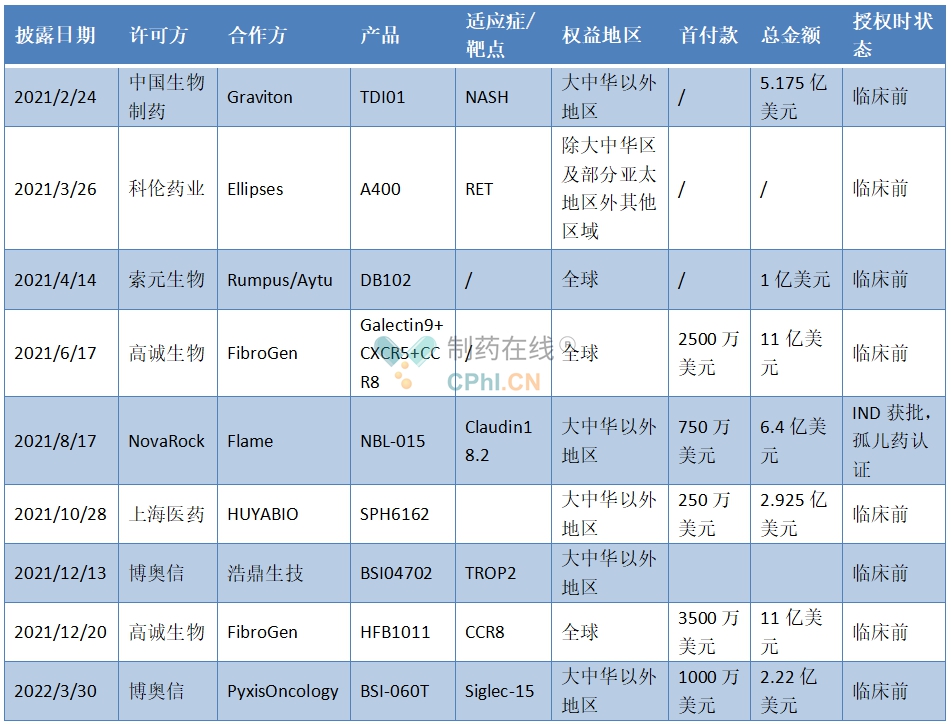
(根据公开资料整理)
当前困境
总的来说,目前,大多数中国创新药研发思路主要是借鉴海外已经上市的first-in-class药物,进行fast-follow研发。license-out项目仍将中国临床数据作为卖出去的砝码,授权金额也不是大多数创新药企的主要收入来源。
根据BCG分析,我国创新药企海外营收只占15%,而国外制药巨头海外收入平均占比都超过60%。特别是,日本武田海外营收占比高达82%,而中国药企海外营收占比最高的复星也才35%。
然而,近两三年来,在研发内卷以及医保灵魂砍价的双重夹击下,国内营收已经难以支撑国内药企经营研发,海外市场的价值愈发凸显,征服海外成为国内药企走出目前困境的重要途径。
如何破局
1.创新是发展的第一动力
首先,产品疗效要过硬。
就拿目前唯二获FDA批准的国产创新药来说,不管是百济神州的泽布替尼还是传奇生物的西达基奥仑赛,能获FDA批准上市,都是靠自身优秀的临床数据。
传奇生物的西达基奥仑赛能够获FDA批准上市,正是基于其漂亮的临床数据才批准其上市。支撑其上市的一项关键性Ib/II期CARTITUDE-1研究结果显示,中位随访12.4个月时,独立委员审查的客观缓解率(ORR)为97%,包括67%的sCR(严格的完全缓解),92.8%的患者获得了非常好的部分缓解(VGPR)及以上。
这些数据优于已获批上市的竞品BCMA CAR-T疗法Abecma。
其次,拓宽药物研发类别。
除了单抗,ADC药物、基因治疗(核酸类药物)等也可以作为研发重点。作为全球首 个CAR-T药物Abecma2021年营收有1.64亿美元。据Evaluate Vantage估测,西达基奥仑赛在2026年的销售额可达到17亿美元。
最后,技术上要有所突破。
例如,天境生物的CD47单抗通过反向筛选降低了红细胞毒 性,因此获得艾伯维青睐。
2.走全球临床试验路子
回看这些成功出海的license-out项目,I期临床阶段大多数选择全球试验,凭借全球临床试验的数据卖出去,然后海外合作方进一步推进II/III期临床试验。
加科思就是第一个“吃螃蟹的人”。2018年4月,加科思在美国开展SHP-2抑制剂I期临床,2020年6月授权艾伯维合作全球开发。
自身推进全球I期临床后授权海外的中国license-out项目
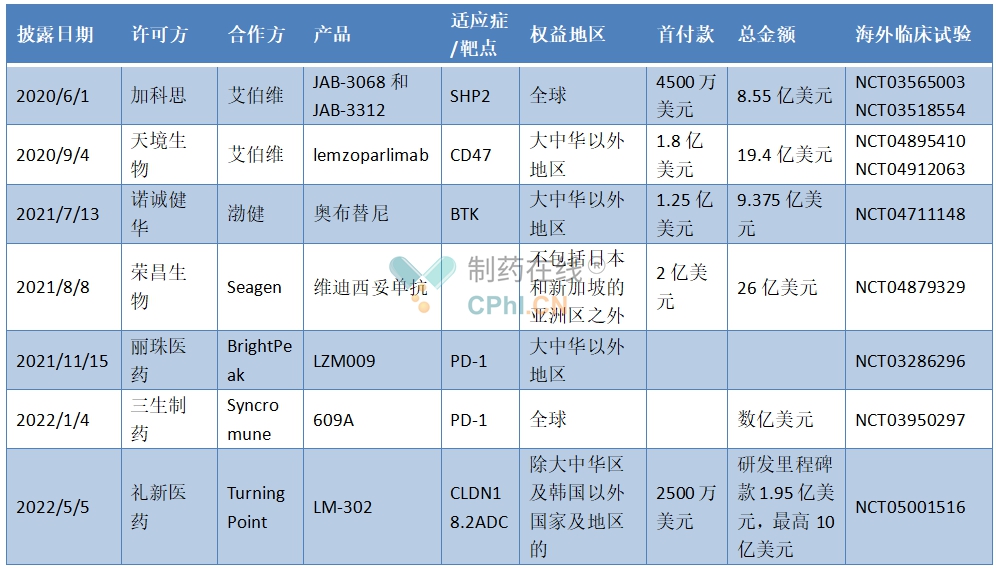
(根据公开资料整理)
3.国际化人才是成功关键因素
挖掘这些license-out项目背后,几乎每一个都有丰富的全球制药巨头临床相关工作背景,有些甚至有FDA审评背景。
一方面,在海外医药巨头有从业背景的高级人才纷纷加入中国创新药企。
2018年,辉瑞原大中华区总裁吴晓滨加入百济神州;2019年,诺华原临床监督运营团队负责人Melika Davis加入百济神州;2021年,阿斯利康原东区RGM、销售顾问委员主席张岸巍,加入罗欣集团;2022年1月,原阿斯利康肿瘤事业部总经理殷敏加入百济神州,担任大中华区首席商务官。
不管是传统Pharma还是新兴Biotech,这些药企背后都有具有海外药企丰富从业经验的人才。
另一方面,FDA审评员迎来归国潮。
2017年,中国正式加入人用药品技术要求国际协调理事会(ICH),真正开始融入国际药品监管体系,中国创新药的中美双报之路由此开启。据不完全统计,2019年后,每年几乎都有二三十位前FDA审评员回国,如今这个群体的规模已经超过了100人。
人才对license-out项目成功出海至关重要。
百济神州的泽布替尼成功在美国上市就离不开出色的注册团队。
2015年开始,泽布替尼注册团队就与FDA沟通产品开发计划,直到2018年,FDA才最终同意百济神州提出的做法。经过多次沟通,在2016-2018的3年间,泽布替尼先后获得FDA授予的“孤儿药认定”、“突破性疗法认定”、“优先审评”等多项特殊认定,这些促成了FDA对产品加速获批的认可。
前途是光明的,道路是曲折的,中国创新药企如何摆脱“内卷之困”,走出去,奔向星辰大海,需要多方面努力。
本文所有统计图表均截至2022年6月6日,本文观点仅代表笔者一家之言,如有片面,欢迎留言讨论。
参考资料:
1.招商证券-医药生物行业创新药系列报告(一):出海路径篇,创新药系列报告框架与中国创新药企出海理想路径假设
2.创新药出海,8图解密
作者简介:@菜菜,毕业于上海交通大学药学专业,多年来一直在药监系统工作,擅长医药热点分析,政策解读等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57