10月12日,璧辰医药旗下在研药物ABM-168的新药临床试验(IND)申请获得了FDA批准,这款药物是其自主研发的小分子选择性MEK1/2抑制剂,可突破血脑屏障进入大脑用于脑部疾病的治疗,有望提高药物脑的部递送效率。
高选择性的MEK1/2抑制剂
ABM-168是璧辰医药自主研发的一款高选择性的MEK1/2抑制剂,可阻断RAS和RAF 突变或信号放大导致的细胞癌变信号通路,进而控制癌细胞生长。
体内的药效学研究结果表明,ABM-168单独使用或与其他药物联合使用在胶质母细胞瘤原位模型、人源黑色素瘤颅内/心内模型、结肠癌皮下移植模型、结肠癌原位肿瘤模型以及胰 腺癌肿瘤模型中均表现出良好的抗肿瘤活性,能有效抑制多种RAS、RAF和NF1突变的癌细胞系的增殖。
特别的,与目前已获批上市的MEK1/2抑制剂不同,ABM-168具有优秀的穿透血脑屏障的能力,可有效杀伤脑转移癌细胞或恶性脑肿瘤细胞。在接下来即将启动的I期临床试验中,ABM-168将用于晚期实体瘤领域的患者,尤其是针对并发脑转移或原发性脑瘤的患者,探索这款在研新药用于上述此类患者的安全性、耐受性、药代动力学及初步的抗肿瘤活性。
璧辰海外临床申请已有先例
值得关注的是,2019年11月,璧辰医药旗下在研小分子BRAF抑制剂ABM-1310 获得了FDA临床试验许可。2020年6月中旬,ABM-1310在美国的I期临床试验启动,临床试验登记号为NCT04190628,拟招募48名具有BRAF V600突变的局部晚期或转移性实体瘤受试者,以评估ABM-1310在这些成人患者中的安全性、耐受性、药代动力学和初步抗癌活性,预计将在2025年完成。
上个月,ABM-1310在中国的I期临床试验启动,拟国内入组72人,目前完成了首例患者入组和给药。试验主要评估ABM-1310 单药治疗BRAF V600 突变实体瘤受试者的安全性和耐受性。在临床终点设计方面,除了安全性及耐受性指标之外。受试者颅内的初步疗效纳入了考虑的范围。
FDA已批准上市的MEK1/2 选择性抑制剂
据报道,全球共有 50 款在研MEK 抑制剂,其中有15 款 MEK1/2 抑制剂。截至目前,FDA批准上市了4款 MEK1/2 选择性抑制剂,按照获批时间依次为诺华的曲美替尼、Exelixis的考比替尼、辉瑞的比美替尼及阿斯利康和默克的司美替尼。
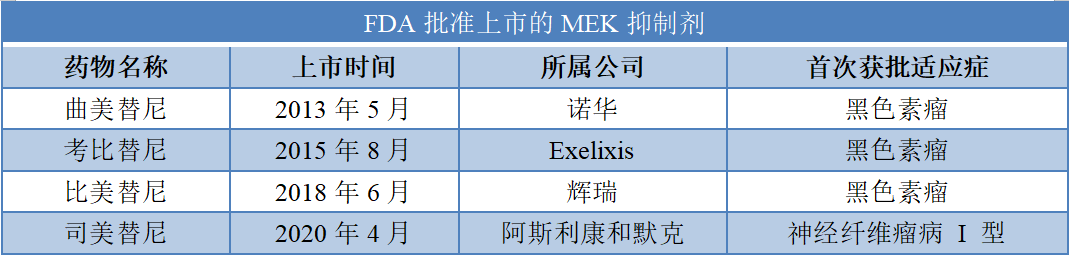
数据来源:公开资料整理
其中,诺华的曲美替尼与达拉非尼双靶向联合治疗药物于 2019年12月经国家药品监督管理局批准在我国上市,适用于治疗BRAF V600突变阳性的不可切除或转移性黑色素瘤。
需要关注的是,目前这些已获批上市的MEK1/2抑制剂均难以突破血脑屏障,针对脑部疾病患者的同类治疗药物领域尚属空白。近年来,璧辰医药专注于可突破血脑屏障的小分子药物研发领域,ABM-168临床前研究结果显示出了优越的血脑屏障参透性,有望成为一种疗效高、毒副作用低、入脑效率高的潜在MEK1/2抑制剂,最终提高肿瘤转移患者的临床获益水平。
国产在研 MEK1/2 抑制剂
除了璧辰医药之外,目前国内共有 4 款 MEK1/2 抑制剂在研,分别为复星医药的 FCN-159、恒瑞的 SHR7390、基石药业的 CS3006 以及正大天晴的 TQ-B3234。
其中,复星医药旗下的 FCN-159 进展最快。今年5月下旬,复星医药收到了国家药品监督管理局关于同意FCN-159片用于动静脉畸形治疗开展临床试验的通知书。同时,FCN-159还围绕晚期实体瘤、I型神经纤维瘤、组织细胞肿瘤等多项适应症展开了研究。
在海外市场的拓展方面,复星医药于去年5月收到了FDA关于同意 FCN-159 片用于治疗成人和儿童 I 型神经纤维瘤病进行临床试验的通知。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57