5月15日,Byondis在官网发布的文件显示,FDA对其SYD985药物用于治疗HER2阳性不可切除的局部晚期或转移性乳腺癌(mBC)的生物许可申请发出了回复函(CRL)。
FDA在CRL中表示,需要更多的信息来支持审批决定,这些信息也需要额外的时间来审查。Byondis对FDA的决定感到遗憾的同时,也表示将继续推进SYD985在欧盟和英国的上市。
创新型HER2 ADC,疗效却不占优势
为了克服上一代HER2ADC(T-DM1)血浆稳定性差、治疗窗口窄的缺点,SYD985在连接子和毒素载荷方面均做了改进。SYD985是Byondis利用其专有的基于duocarmazine的linker-drug技术平台ByonZine开发的新一代HER2 ADC,由曲妥珠单抗和可切割的linker-drug缬氨酸-瓜氨酸-seco-Duocarmycin-hydroxyBenzamide-Azaindole(vc-seco-DUBA)组成。
SYD985与癌细胞表面的HER2结合后被细胞内化,随后linker在蛋白酶的作用下断裂,释放出细胞毒素药物seco-DUBA,它可以与DNA小沟结合破坏细胞和核酸结构,最终导致肿瘤细胞死亡。通过ByonZine技术平台设计的SYD985,在血液循环中高度稳定,如果细胞毒素药物提前释放,该药物会迅速自毁,从而减少其对正常组织的损害并扩大治疗窗口。
为了减少副作用,SYD985的DAR(药物抗体比)设置的较低,仅为2.8,虽然影响了药物的打击效果,但SYD985具有旁杀效应,在一定程度上改善了疗效。
就是这么一款创新型HER2 ADC,其上市却遭到FDA拒绝,背后原因要从临床数据讲起。
SYD985的生物制剂许可申请(BLA)主要是基于其关键III期TULIP研究结果。该试验是一项随机、多中心、开放标签的临床试验(n=436),比较了SYD985与医生选择的方案(PC)治疗不可切除的HER2+局部晚期或转移性乳腺癌患者的疗效。研究的主要终点为无进展生存期(PFS)。
结果显示,与PC组相比,SYD985组患者的PFS显著延长(7.0 vs 4.9个月;HR=0.64;P=0.002),达到了试验的主要终点。在次要终点总生存期(OS)上,SYD985组为20.4个月,PC组为16.3个月,虽然SYD985带来了近4个月的生存期改善,但由于P值为0.153,其代表着与PC组相比,SYD985带给患者的OS改善并不显著。
安全性方面,SYD985组vs PC组分别有52.8%和48.2%的患者经历了≥ 3 级不良事件,SYD985组有3例(1%)患者经历了任意级别的间质性肺病(ILD),其中 1 例 ≥ 3 级。
再看HER2 ADC领域"天花板"DS-8201的临床数据,在DESTINY-Breast02(DB02)试验中,针对HER2阳性不可切除和转移性乳腺癌患者,在主要终点PFS上,DS-8201组 vs PC组:17.8 vs 6.9个月;在次要终点总生存期(OS)上,DS-8201组 vs PC组:39.2 vs 26.5 个月。
经过对比,高下立判,如今DS-8201几乎改变了HER2+乳腺癌二线甚至整体治疗格局,因此SYD985要想分一杯羹,必须拿出显著差异化的数据,显然,目前无法实现。
对国内后来者的影响
HER2属于表皮生长因子受体(EGFR)家族,在约15%-20%的乳腺癌患者中表达。同时HER2是一种原癌基因,可引起癌细胞的分裂与增殖。由于其表达量在多种肿瘤细胞与正常组织细胞中差别较大,介导内吞能力较好,因此,HER2是ADC的优选靶点。
目前全球已有三款HER2 ADC获批上市,分别是罗氏的Kadcyla(T-DM1,恩美曲妥珠单抗),第一三共/阿斯利康的Enhertu(DS-8201,T-Dxd,德曲妥珠单抗),以及荣昌生物的爱地希(RC48,维迪西妥单抗),获批的适应症涉及乳腺癌、胃癌、尿路上皮癌等。
与国外相比,国内HER2 ADC的研发热情高涨。目前,国内已有多款HER2 ADC进入临床阶段。
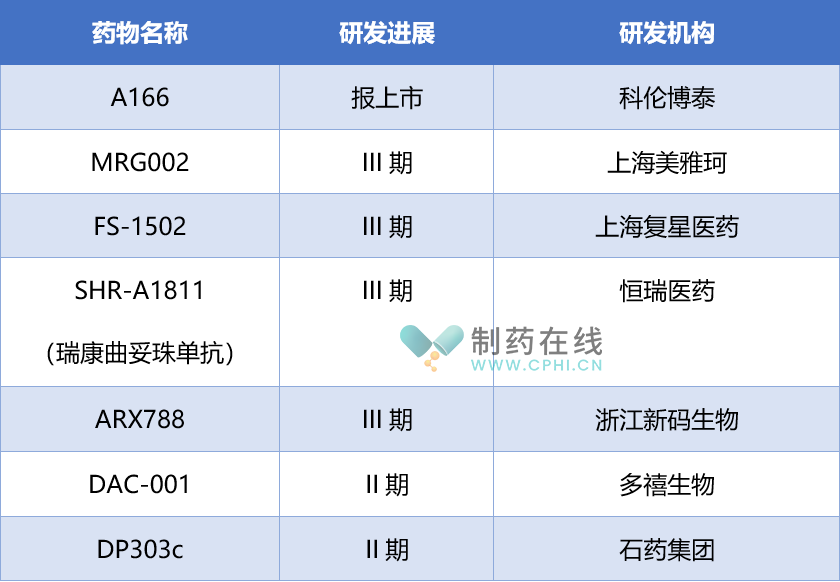
国内处于II、III期的在研HER2ADC(公开资料)
其中,科伦博泰的A166的上市申请已于近期获NMPA受理,拟定适应症为既往经二线及以上抗HER2治疗失败的HER2+不可切除的局部晚期、复发或转移性乳腺癌。
在2022ASCO年会上,科伦博泰公布了A166用于经过多线治疗的HER2+乳腺癌患者的I期剂量扩展研究数据:4.8mg/kg组ORR达73.9%,中位PFS达12.3个月。目前,A166正在开展多项临床试验。
ARX788是新一代采用非天然氨基酸技术实现定点偶联的抗HER2 ADC,近期公布的在HER2+乳腺癌的III期临床研究 (ACE-Breast-02)中达到了预先制定的中期主要疗效终点,相对于卡培他滨和拉帕替尼,PFS显示出统计学差异。针对12个月内使用DS-8201耐药的患者,ARX788有效率约25%。基于此,新码生物拟向CDE沟通申请提前终止研究并提交新药上市申请。
SHR-A1811由曲妥珠单抗、可裂解四肽连接子和新型拓扑异构酶 I 抑制剂载荷 SHR9265 组成,在多种乳腺癌和胃癌细胞系中表现出 HER2 依赖性生长抑制作用,并具有旁观者效应。在2023 AACR会议上,恒瑞医药公布了SHR-A1811的全球多中心I期临床试验结果。在250 例在转移疾病状态下既往接受过中位数为 3 的前线治疗的患者中,ORR 为 61.6%(95%CI 55.3-67.7),6 个月 PFS 率为 73.9%。
当前 SHR-A1811处于临床 III期阶段,分别针对 HER2+乳腺癌和HER2低表达乳腺癌。
DS-8201的横空出世,使得HER2 ADC后来者们要想成功上市,必须有超凡的实力。FDA拒绝SYD985上市只是一个开始,随着ADC研发热情的高涨,后续FDA对热门靶点ADC的审评必将提高标准。未来只有具备更好安全性、更多元化的适应症或在联合治疗等方面展现出优异疗效的实力选手,才能从群雄逐鹿的赛道中突围而出。希望国内药企能够在抗体、连接子、毒素上做出真正的创新改造,往更多无人区探索,从而创造更大的临床价值。
主要参考资料:
1、 http://www.cninfo.com.cn/new/disclosure/detail?stockCode=002422&announcementId=1216795846&orgId=9900012788&announcementTime=2023-05-11;
2、 Tarantino P, Hamilton E, Tolaney SM, et al. HER2-Low Breast Cancer: Pathological and Clinical Landscape. J Clin Oncol. 2020;38(17):1951-1962. doi:10.1200/JCO.19.02488;
3、 《以古为镜,可以知兴替。后DS-8201时代,ADC药物从哪里来?到哪里去?》,东亚前海证券,2022-06-22;
4、 Quanxia Lv, Ziyuan Meng, Yuanyuan Yu, Feng Jiang, Daogang Guan, Chao Liang, Junwei Zhou, Aiping Lu and Ge Zhang, Molecular Mechanisms and Translational Therapies for Human Epidermal Receptor 2 Positive Breast Cancer, Int. J. Mol. Sci. 2016, 17, 2095.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57