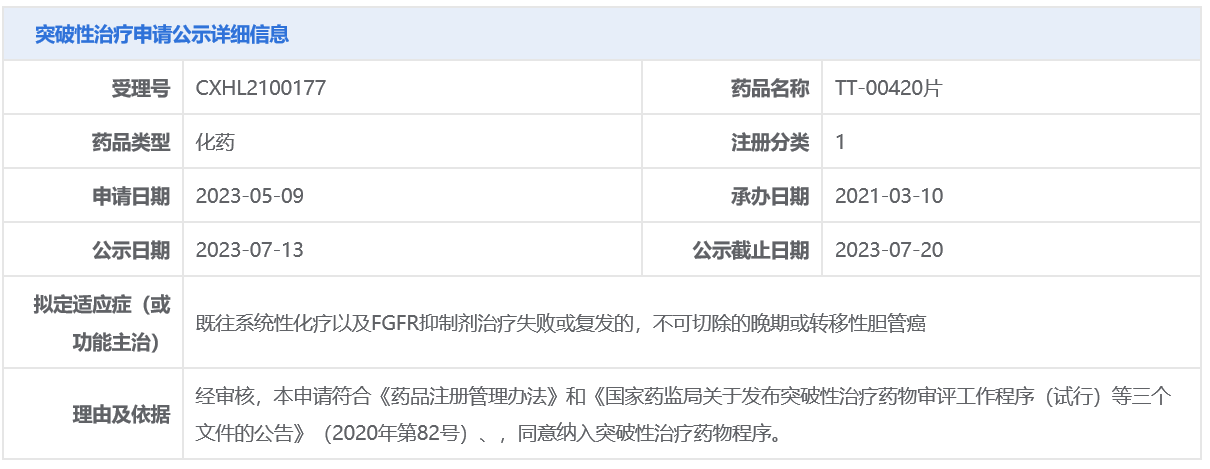
近日,中国国家药监局药品审评中心(CDE)官网公示,药捷安康1类新药TT-00420片(Tinengotinib)拟纳入突破性治疗品种,拟定适应症为:既往系统性化疗以及FGFR抑制剂治疗失败或复发的、不可切除的晚期或转移性胆管癌。
Tinengotinib是一种光谱选择性多激酶抑制剂,通过抑制参与细胞因子信号传导和受体酪氨酸激酶(FGFR 和 V E G F R)的 Aurora 激酶 A/B 和JAK来靶向细胞增殖、血管生成和免疫肿瘤学途径参与肿瘤微环境。Tinengotinib临床前研究显示其在在耐药突变方面具有独特的优势,独特的靶点组合和作用机制能够有效治疗高度异质性肿瘤。以此来解决胆管癌领域高度未满足的临床需求:非FGFR/FGFR2原发耐药/FGFR2获得性耐药胆管癌;独特多激酶抑制剂协同作用针对高度异质性包括无明确基因突变的胆管癌。 此前Tinengotinib已获得 FDA 授予的治疗胆管癌的孤儿药认证和快速通道资格认证。
据 Insight 数据库显示,Tinengotinib 已经登记启动 5 项临床试验,在胆管癌之外还布局了三阴乳腺癌,均推进至临床 II 期。
Tinengotinib市场潜力不容小觑
FGFR抑制剂经治耐药的胆管癌(CCA)是Tinengotinib全球进展最快的适应症。根据Frost&Sullivan报告,2021年全球CCA新发病人数超过26万人(2017年至2021年年复合增长率达3.6%),其中存在FGFR突变的患者比例高达25.2%。FGFR作为目前“不限癌种”疗法聚焦的热门靶点之一,带来了富有想象的巨大的泛肿瘤市场。据了解,FGFR畸变在实体瘤患者中普遍存在,约占全部实体瘤患者的7.1%。在此基础上,有机构预测,全球泛FGFR抑制剂市场规模将于2035年增至215亿美元,中国泛FGFR抑制剂预计于2030年达到7.8亿美元。但目前在全球能够克服FGFR抑制剂经治耐药的市场尚存巨大空白,FGFR信号通路的抑制容易产生多基因突变,新一代FGFR药物必须同时对所有突变有效,因此药物开发难度指数级增加,而Tinengotinib抑制多基因突变的性质,对有效性和克服耐药性展现了其独特性的价值,正在细分赛道全球领跑。
此外,Tinengotinib作为激酶抑制剂,选择性地抑制与肿瘤密切相关的靶点通路,从而起到协同作用,使其在许多末线、且高度异质性的肿瘤方面展现出独特的治疗潜力,如转移性去势抵抗前列腺癌(mCRPC)、转移性Her2阴性乳腺癌等,使其适应症扩展至除FGFR以外的多个百亿级市场。
Tinengotinib临床数据亮相国际会议
2023 年ASCO大会上,药捷安康公布了tinengotinib单药和联合用药治疗晚期实体瘤的Ib/II期安全性和有效性数据。Tinengotinib单药在5mg-12mg之间PK初步分析显示暴露量随剂量增加而增加,每日一次给药(QD)和每日两次给药(BID)的两种不同给药频率药物暴露量无明显差异。单药治疗组患者耐受性良好,联用治疗组的耐受性评估正在进行中。Tinengotinib在前列腺癌、HR阳性/HER2阴性乳腺癌、三阴乳腺癌和胆管癌患者中的总体缓解率(ORR)分别为50%(5/10)、40%(2/5)、50%(3/6)和20%(3/15)。
TT-00420单药治疗晚期实体瘤患者的首次人体I期研究结果在2022年ASCO年会上展示。该项研究(NCT03654547)是一项针对TT-00420的I期剂量递增和扩展研究,共纳入48例晚期实体瘤成年患者。研究显示:TT-00420 单药治疗晚期实体瘤安全且耐受性良好。在42例疗效可评估的患者中,有7例达到了肿瘤的部分缓解(PR),分别是3例胆管癌(CCA)、2例三阴性乳腺癌(TNBC)、1例HER2-的乳腺癌和1例去势抵抗性前列腺癌。该研究支持在晚期CCA患者中TT-00420以10mg/d的剂量进行II期研究。
参考来源
1.CDE官网
2.药捷安康官网
3.Preliminary safety and efficacy of tinengotinib tablets as monotherapy and combination therapy in advanced solid tumors: A phase Ib/II clinical trial.
4.药捷安康核心产品TT-00420获美国FDA快速通道资格认定. Retrieved Oct 27,2021, from https://mp.weixin.qq.com/s/_lFql2cwWeUxZ7bUftH5nw



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57