
本期我们分享GMP指南(2023版)第9章--稳定性研究。
扫码进群领取1300问电子版

为什么要进行稳定性研究
稳定性研究考察的内涵是通过研究原料药、中间产品或制剂的性质在温度、湿度、光线等条件的影响下随时间变化的规律。通过这种变化规律为药品的生产、包装、贮存、运输条件和有效期的确定提供科学依据,同时通过试验建立药品的有效期,从而保障用药的安全性有效。但是持续稳定性考察和稳定性考察的目的有所不同,持续稳定性考察的目的是在有效期内监控已上市药品的质量,确定药品可以或预期可以在标示的贮存条件下,符合质量标准的各项要求。
► 稳定性研究考察的内涵是什么?
► 稳定性研究的最终目的是什么?
► 持续稳定性考察的目的是什么?
► 稳定性研究贯穿哪些药品阶段?
► 稳定性研究始于什么阶段?
► 稳定性研究终于什么阶段?
稳定性研究的内容与技术要点
上市前稳定性研究包含内容包括影响因素试验、加速试验以及长期试验,上市后包括持续稳定性研究和承诺稳定性试验,持续稳定性研究条件等同于长期稳定性试验,承诺稳定性试验条件为加速试验和长期稳定性试验。稳定性研究的技术要点内容包括遵循原则、设计结合、市场销售、试验批次、注册阶段要求、包装要求、试验规模以及试验流程。
► 稳定性试验应遵循什么原则?
► 稳定性试验设计应结合什么?
► 稳定性试验从法规角度考虑应该满足什么?
► 我国市场销售的产品应参照什么?
► 影响因素试验用几批进行?
► 生物制品应使用几批次研究影响因素试验?
► 上市前用几批供试品进行?
► 上市后用几个批次进行?
► 根据ICH Q1A(R2),对注册阶段的药品有哪些批次研究要求?
► 原料药供试品批量如何设计?
► 药物制剂供试品批量如何设计?
► 特殊品种特殊剂型批量如何设计?
► 加速与长期试验所用包装有什么要求?
► 稳定性试验应重视什么?
► 放大试验比规模生产的数量要小,后续怎么办?
► 对包装在有通透性容器内的药物制剂应当考虑什么?
► 常规稳定性试验流程?
设计方案
稳定性研究的设计方案要具有代表性,要能反映出研究目的,其考察时间点设计要基于对药品性质的认识和对稳定性趋势评价的要求。对于上市后持续稳定性考察试验点一般由企业根据具体情况制定,一般推荐每年一次,或至少开始、中间及效期时测定,企业可以简化设计方案,但必须要保证符合法规要求。考察项目的设计应根据药品特点和质量控制的要求,尽量选择能反映药品稳定性的指标,方案的内容至少应包括规格、批次、检验方法、检验方法依据、合格标准、容器密封系统的描述;试验间隔时间;贮存条件;检验项目,如检验项目少于成品质量标准所包含的项目,应说明理由。
► 稳定性研究样品批次选择注意事项?
► 考察时间点设计应基于什么?
► 推荐的稳定性试验点有哪些?
► 对于上市后持续稳定性考察试验点应如何考虑?
► 什么是简化方案设计,应考虑哪些因素?
► 简化方案设计方法有哪些?
► 稳定性研究的考察项目应考虑什么因素?
► 稳定性设计内容至少包括哪些?
样品贮存
影响样品贮存的条件因素包括温度、湿度和包装,一般规定长期条件为25℃±2℃、相对湿度 60%±5%,加速条件为加速 40℃±2℃、相对湿度 75%±5%。当采用 25℃±2℃、相对湿度60%±5%作为进行长期试验时,当加速试验 6 个月期间的任何一时间点发生了"显著变化",则应进行中间试验,并对照显著变化的限度标准进行评价,如果进行中间试验,最好包括所有试验项目。原料药的"显著变化"一般指不符合规定,药物制剂质量的"显著变化"通常定义为含量与初始值相差 5%(特殊情况应加以说明);或采用生物或免疫法测定时效价不符合规定;降解产物超出标准限度要求;外观、物理常数、功能试验等不符合标准规定;pH 值不符合规定; 个制剂单位的溶出度或释放度不符合标准规定。稳定性试验的包装应与拟上市产品的包装一致。原料药可采用模拟小包装,所用材料和封装条件应与大包装一致。
► 样品贮存条件包括哪些因素?
► 世界范围内气候带有哪些?
► 《中国药典》规定温湿度条件有哪些?
► 中药、天然药物可采用哪些条件?
► 什么条件下要启动中间试验?
► 中间试验应包括所有试验项目么?
► 初次申报应包括哪些内容?
► 原料药的"显著变化"指什么?
► 药物制剂质量的"显著变化"通常定义为什么?
► 稳定性试验样品的包装有什么要求?
稳定性研究其他管理
稳定性研究其他管理还包括样品取用、样品分析、光学稳定性、微生物分析、数据的评估、统计分析的程序、上市稳定性考察以及文件管理。样品取出的时间允许发生偏差,但基于稳定性试验的目的进行充分风险评估后规定;注册申报应结合产品前期稳定性相关研究数据以及注册地相关注册要求谨慎考虑;用于持续稳定性考察的取出时间偏差设定可相对放宽要求。但最后一个时间节点不得早于计划时间点,一般不推荐提前取出。企业应当制定取出样品后应在多长时间内完成分析,一般样品取出后在1个月取出时,推荐2周内完成,对于更长时间点的,建议4周内完成。数据评估的目的时确定可能影响原料药或制剂质量和性能的关键质量属性,以确定复验期和有效期,确定贮藏和包装条件,最终效期的确定一般以长期试验结果为基准。
► 样品取出的时间是否允许有偏差范围存在?
► 取样时间偏差范围设定应基于什么?
► 影响因素试验和加速试验是否可以提前取出?
► 是否需要制定取出后样品应多长时间内完成分析?
► 什么时模拟使用测试?
► 模拟使用测试应检测哪些项目?
► 光学稳定性的目的是什么?
► 光学稳定性试验对于新原料药和产品是必须试验内容么?
► 光学稳定性试验批次怎样设计?
► 用于保护制剂不受细菌和真菌污染的防腐剂的量在什么时候必须确定?
► 当批准效期结束时或者研发过程中发现防腐剂量低于处方量,应该怎么办?
► 稳定性考察期间防腐剂和微生物在哪些检测点进行检验?
► 稳定性试验开始时是否需要对每批样品进行无菌检查?
► 注册阶段的药品稳定性研究的数据目的是什么?
► 贮藏条件的确定应参考哪些分析要素?
► 包装材料/容器的确定应参考哪些分析要素?
► 有效期的确定应参考哪些分析要素?
► 注册阶段,原料药或制剂复验期或有效期可以参考什么?
► 统计分析的目的是什么?
► 对后续稳定性承诺批次的数据进行分析的统计方法有什么要求?
► 药品获批后,采用实际生产规模的药品继续进行长期试验的目的是什么?
► 变更后是否需要进行稳定性研究?
► 持续稳定性考察的目的是什么?
► 企业是否需要建立标准操作规程去制定稳定性试验的程序和要求?
► 稳定性研究方案如果发生标准变更应怎么办?
质量控制实验室GMP指南(2023版)1300问概况及分享规划
GMP指南质量控制实验室共包含15个章节,主要内容如下图所示:
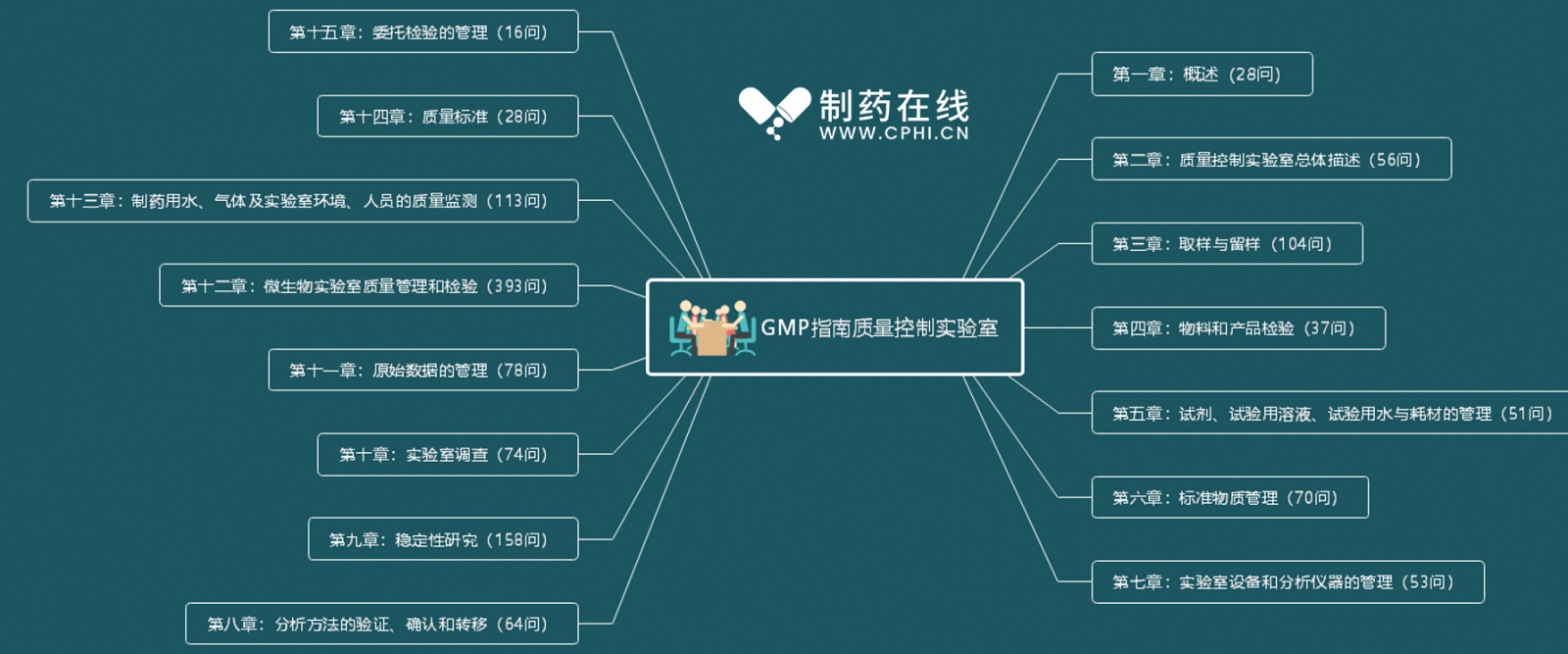
本系列分享共计12期,具体分享规划如下:
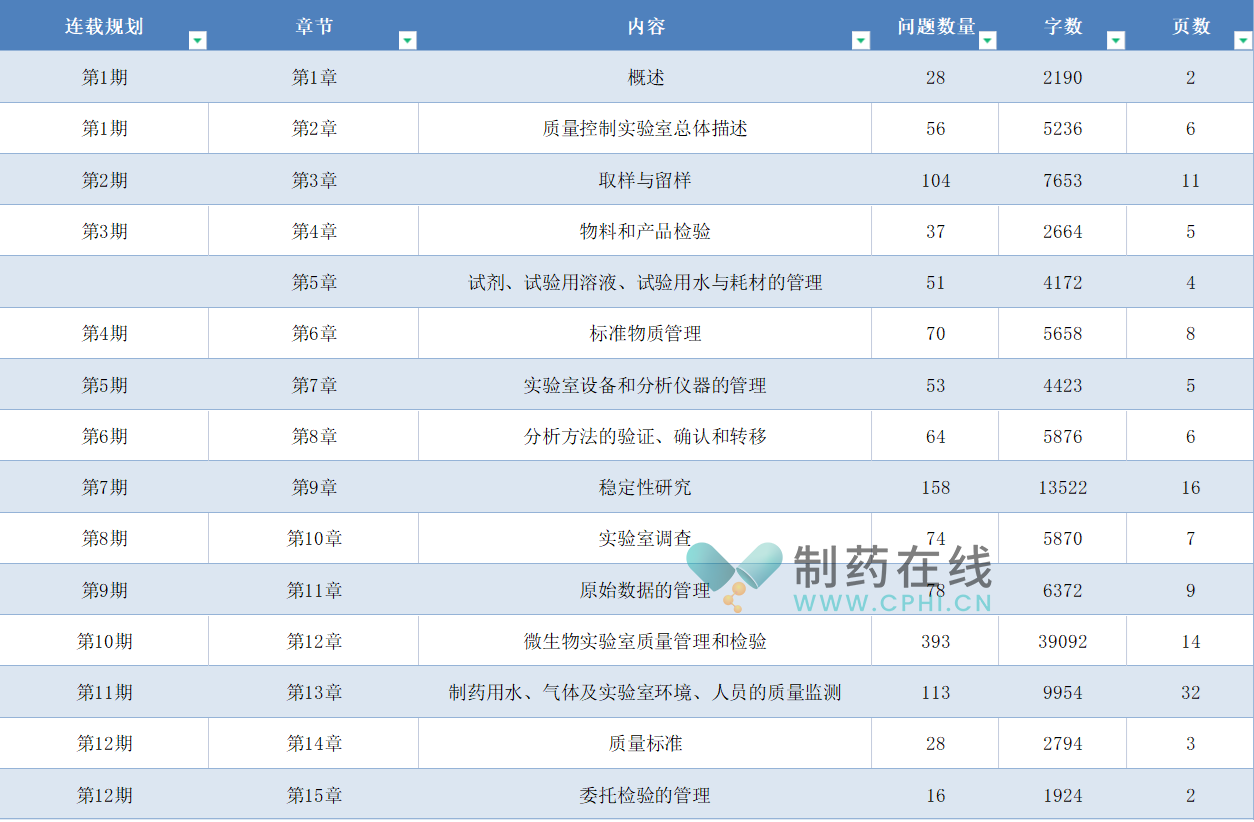
质量控制实验室GMP指南(2023版)1300问电子版将分12期发送
扫描下方二维码进入智药研习社微信社群领取
*已在1-3群的朋友不用重复加群




















合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57