质量控制实验室GMP指南(2023版)1300问系列分享共计12期,具体分享规划如下。本期我们分享GMP指南(2023版)第11章--原始数据的管理。
扫码进群领取1300问电子版

原始数据的那些点
原始数据的基础要求一般是能够全面重构生产活动,通常被定义为原始记录(数据),可以被描述未初次采集的数据,无论该记录为纸质的,还是以电子方式呈现。记录是指再药品研制、生产、经营、使用等活动中通过一个或多个数据记载形成的,反映相关活动执行过程与结果的凭证,可以是纸质的,也可以是电子的或其他载体形式。电子记录是指一种数字格式的记录,由文本、图标、数据、声音、图示或其他数字信息构成。其创建、修改、维护、归档、读取、发放和使用均由计算机(化)系统实现。如果以动态采集并以电子方式生产的数据,纸质副本不能被认为是原始数据,但是简单仪器不能存储电子数据,打印条可以被认定为原始数据。
► 什么是原始数据?
► 原始数据的基础要求是什么?
► 动态采集并以电子方式生产的数据,纸质副本是否可以被认为是"原始数据"?
► 简单仪器不能存储电子数据,打印条能否构成原始数据?
► 若简单仪器电子数据可以储存但是容量有限应该怎么办?
► 如何理解"最初在动态状态下采集的信息应该在该状态下保持可用"?
元数据
元数据是用来定义或描述数据的数据,通过定义和描述数据,可以支持对其所描述的数据对象的定义、查询、交换、追踪、访问控制、评价和保存等诸多管理工作。元数据描述数据的特性包括数据的结构、数据要素、数据的内在关系和其他特性,比如审计跟踪。审计跟踪是一种形式的元数据,包括与创建、修改或删除GXP记录有关动作的信息,其有助于重构与记录有关的事件的历史,无论是何种介质,包括动作的:何人何事何时何为"信息,审计跟踪提供了安全保障,比如创建、增加、删除或修改纸质或电子记录的信息而不隐藏或覆盖原始记录。
► 什么是元数据?
► 元数据主要描述数据的哪些特性?
► 元数据是否被允许追溯至个人?
► 脱离了元数据的信息背景,数据还是否有意义?
► 什么是审计跟踪?
► 审计跟踪的作用是什么?
► 审计跟踪为记录提供了哪些保障?
原始数据包括内容
原始数据的范围至少应包括以下内容:
► 实验室基础管理记录(人员进出记录、房间设备温湿度记录、文件发放回收记录等);
► 人员(培训、上岗、账户及权限管理记录);
► 各类容器具仪表校准、仪器确认及校准记录;
► 各类仪器及耗材的使用及维护记录;
► 试剂/标准品/试液/滴定液/培养基等的出入库、称量、制备、使用及销毁等记录;
► 样品取样、登记、保存、领用和发放、流转、使用及销毁等记录;
► 样品称量、溶液制备、仪器操作等测试过程记录;
► 检验记录或实验室工作日志等;
► 检验设备中记录、图谱和曲线图等,如液(气)相色谱图、紫外-可见光吸收图谱,红外光吸收图谱及对应的电子数据;
► 从检验设备中打印的记录,如天平、pH 计的打印条等;电子数据处理系统、照相技术活其他可靠方式记录的电子数据及打印件;
► 带有原始数据信息的验证方案和报告;
► 纸质和电子数据的复核审核记录;
► 放行审核记录、质量事件调查记录; 关键废弃物的处理记录;
► 稳定性和留样出入库及定期观察等记录。
纸质记录
纸质记录的内涵是反映生产、控制、检验等操作活动的证据,涉及时应紧扣相应管理规程/操作规程的要求,确保可填写有效的信息以供追溯,便于人员规范填写,空间充足,包含主要控制参数、限度、要求等,便于人员参照。一般空白记录的获取方式有纸质母版复印和母本电子件打印两种方式,纸质模板的管理应上锁或其他更合适的方式,而母本电子件的受控措施是专用电脑、服务器或者数据库中,并设置权限,只有指定的记录管理人员才能打印或发放。
► 设计记录的注意事项是什么?
► 纸质记录的本质内涵是什么?
► 电子件有哪些类型?
► 母本纸质版的受控措施有哪些?
► 母本电子件的受控措施有哪些?
► 空白记录的受控方式有哪些?
► 记录的发放有哪些受控方式?
► 记录发放可追溯的手段有哪些?
电子数据/记录
实验室电子数据包括电子数据处理系统、照相技术或其他可靠方式记录的各种电子化数据资料。电子数据在经授权人员更改、修改应当经过批准、记录更改数据理由、记录更改记录、建立数据审计跟踪系统、禁止更改后覆盖原始数据的前提下,电子数据是可以更改的。
► 实验室电子数包括哪些类型?
► 离岗或调岗人员的账户应怎样处理?
► 密码是否需要定期更新?
► 电子数据是否可以更改?有哪些额外条件?
► 空间受限的仪器电子数据是否可以删除?
► 电子数据备份的形式有哪些?
► 电子数据备份内容包括哪些?
质量控制实验室GMP指南(2023版)1300问概况及分享规划
GMP指南质量控制实验室共包含15个章节,主要内容如下图所示:
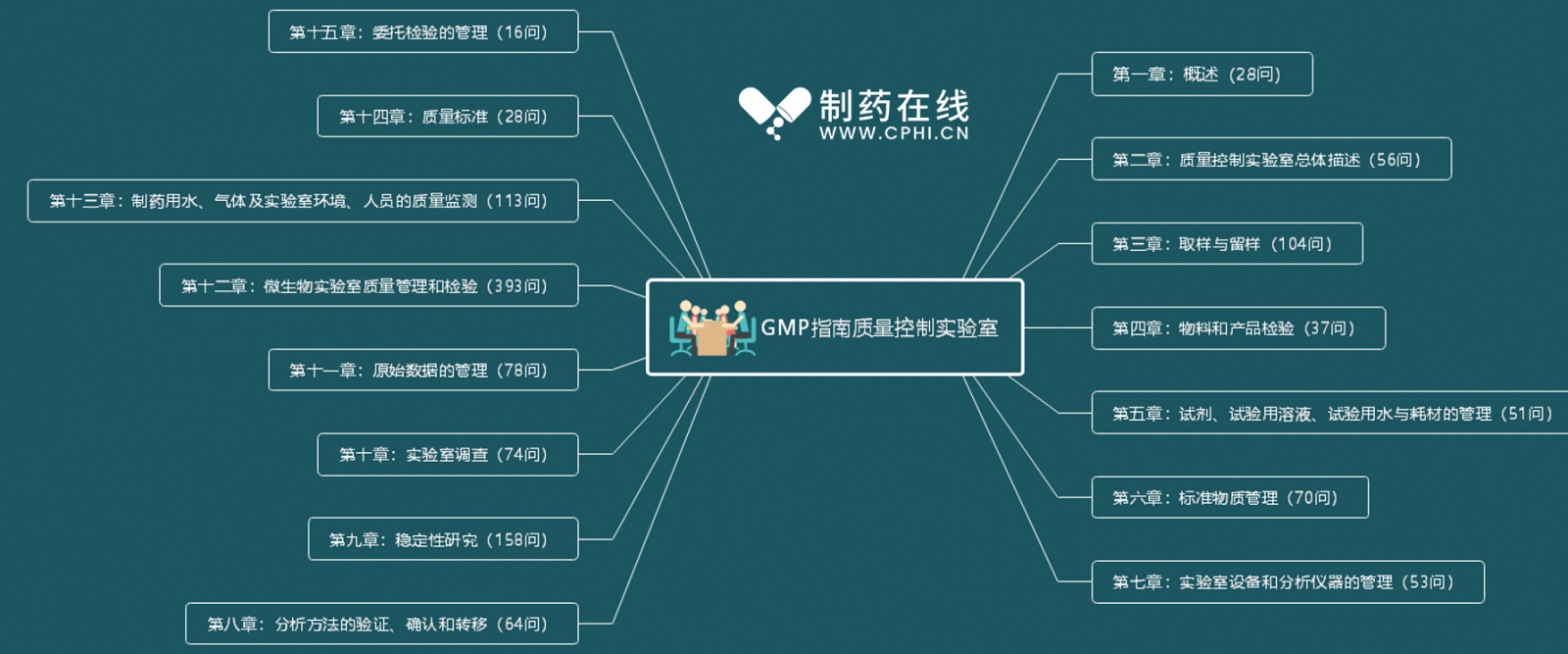
本系列分享共计12期,具体分享规划如下:

质量控制实验室GMP指南(2023版)1300问电子版将分12期发送
扫描下方二维码进入智药研习社微信社群领取
*已在1-3群的朋友不用重复加群













合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57