质量控制实验室GMP指南(2023版)1300问系列分享共计12期,具体分享规划如下。本期我们分享GMP指南(2023版)第10章--实验室调查。
扫码进群领取1300问电子版

要懂的几个术语
对于实验室调查一定要懂的术语有:超标(out of specification OOS)、超趋势(out of trend OOT)、异常(atypical/aberrrant/anomalous result AR)、假设性检验(hypothesis/investigative testing)、复验(re-test)、重新取样(re-sample)、可归因的原因(根本原因,assignable cause)、无可归因的原因(未知原因,no assignable cause)。另外我们还需要了解OOT与OOS区别(OOT 结果不一定是 OOS,而是看起来不像是正常数据点的结果。)
► 什么是超标?
► 什么是超趋势?
► OOT与OOS区别?
► 什么是异常?
► 什么是假设性检验(hypothesis/investigative testing)?
► 什么是复验(re-test)?
► 什么是重新取样(re-sample)?
► 什么是可归因的原因(根本原因,assignable cause)?
► 什么是无可归因的原因(未知原因,no assignable cause)?
所有的都要进行调查吗?
适用实验室调查情况:批次放行检验;起始物料检验;过程控制检验(如果数据用于批量计算/决策、申报资料和分析报告中);对已上市批次的成品和活性物成分的稳定性研究,持续/后续稳定性研究(不包括破坏性试验);先前放行的批次在OOS调查中作为参照样品显示OOS或可疑结果的;用于临床试验的批次;在进行药典规定的某些特殊项目分析的复试时,如含量均匀度和溶出度,可不启动 OOS。但需注意是否存在溶出度或含量均匀度不符合正常趋势的情况,如存在,可采取偏差等其他形式展开调查。
不适用实验室调查情况:工艺中未达到终点而进行的中间检测,如工艺调整(pH、黏度的调整等);在可变参数下进行的用于检查漂移影响的研究;培训过程中产生的数据;不需要开启实验室调查的某些包材的物理检测,如长度、外观,中药材及中药饮片的外观、性状等;微生物调查见本指南"12 微生物实验室质量管理和检验"。
► 实验室调查适用于哪些方面?
► 实验室调查不适用于什么情况?
调查阶段划分
实验室调查可以分为可以分为两个阶段;第一阶段:实验室初步调查;第二阶段:扩展性/全面调查。也可以分为三个阶段:第一阶段:实验室初步调查;第二阶段:扩展性/全面调查;第三阶段:调查回顾、总结和批次处置。 两个调查阶段可以同步进行,也可以分开进行。如果分开进行,当缺乏结论性证明 OOS/OOT/AR 是质量控制实验室错误所导致,则应启动第二阶段调查。
► OOS/OOT/AR调查可以分为几个阶段?
► 两个调查阶段是否可以同步进行?
► 一般什么什么时候启动第二阶段调查?
► 当第Ⅰa阶段调查发现明显差错时应怎样处理?无明显差错时应怎样处理?
► 第Ⅰb阶段调查方面有哪些?
► 第Ⅰb阶段调查推荐什么方法?
► 第Ⅰb阶段调查有可归因或可归因不明确应如何处理?
► 第Ⅰb阶段调查内容一般包括哪些?
► 第Ⅰb阶段是否可以进行假设性检验?应怎样进行?
► 进入第Ⅱ阶段调查,化验室是不是不需要在进行调查?
► 第Ⅲ阶段应调查回顾哪些内容?
► 第Ⅲ阶段调查未找出根本原因应怎么办?
► 第Ⅲ阶段没有根本原因,但已经做出产品拒绝,后续持续调查结果是否可以推翻?
OOS/OOT/AR判定依据及差错分析
如果确定一个数据是否为OOS/OOT/AR,最主要的方法是对照质量标准和对照历史趋势,建议企业根据产品年度质量回顾数据或持续工艺确认数据等制定可执行的内控标准。当调查发现为明显差错时可以进行直接记录并纠正无效结果,无需进一步调查,如果没有发现无明显差错那么就要启动实验室调查。一般的明显差错包括:计算错误、断电、设备故障、检验差错、不正确的仪器参数等。具体的处理措施如下:
► 计算错误:重新计算,确定为计算错误。检验员和主管审核,更正后签名前日期。
► 断电:检验员和主管记录该事件,在所有相关的文件记录中备注"断电"重复该分析。
► 设备故障:检验员和主管记录该事件,备注"设备故障;重复该分析",并引用维护记录。
► 检验差错:例如,样品溶液溢出、样品转移不完全。
► 不正确的仪器参数:日禄,检测器波长设置错误,检验员和主管记录该事件,在所有相关的文件记录中备注"不正确的仪器参数,重复该分析"。
质量控制实验室GMP指南(2023版)1300问概况及分享规划
GMP指南质量控制实验室共包含15个章节,主要内容如下图所示:
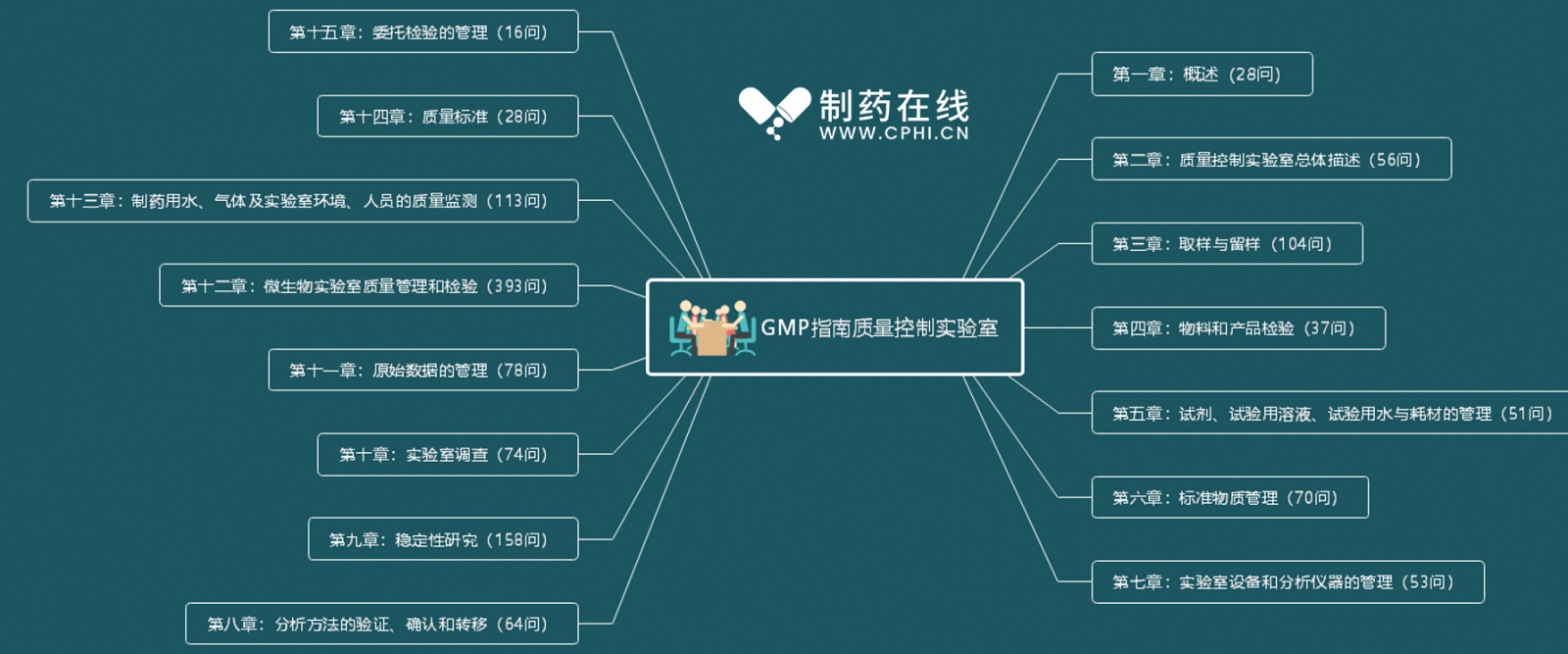
本系列分享共计12期,具体分享规划如下:

质量控制实验室GMP指南(2023版)1300问电子版将分12期发送
扫描下方二维码进入智药研习社微信社群领取
*已在1-3群的朋友不用重复加群













合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57