每个人的悲欢各不相同;在很多人为一个周边礼物买不到,或者为一次旅游不顺心而苦恼的时候,还有人为自己的疾病无法救治而遭受痛苦折磨。在人类所遭受的各类疾病中,有一些疾病的患者人数极少,因此这些疾病被称为罕见病,而治疗罕见病的药物也被称为孤儿药。为了促进国际社会对罕见病的重视,促进国际社会对罕见病患者的关怀,设立了国际罕见病日。国际罕见病日(Rare Disease Day)是每年二月的最后一天。今年的2月29日是第十七个国际罕见病日,今年的国际主题仍旧贯彻"点亮你的生命色彩"(Share Your Colours)。
目前,全球罕见病药物研发的热度持续不减,资本不断涌入罕见病药物研发领域,为罕见病医药市场注入了生机和活力。根据Evaluate《2022 年孤儿药报告》中发布的最新数据,孤儿药市场的增长速度是非孤儿药市场的两倍多,2021-2026 年的复合年增长率为 12%。到 2026 年,孤儿药将占所有处方药销售额的 20%,占全球药物管线价值的 1/3 左右。(图1)
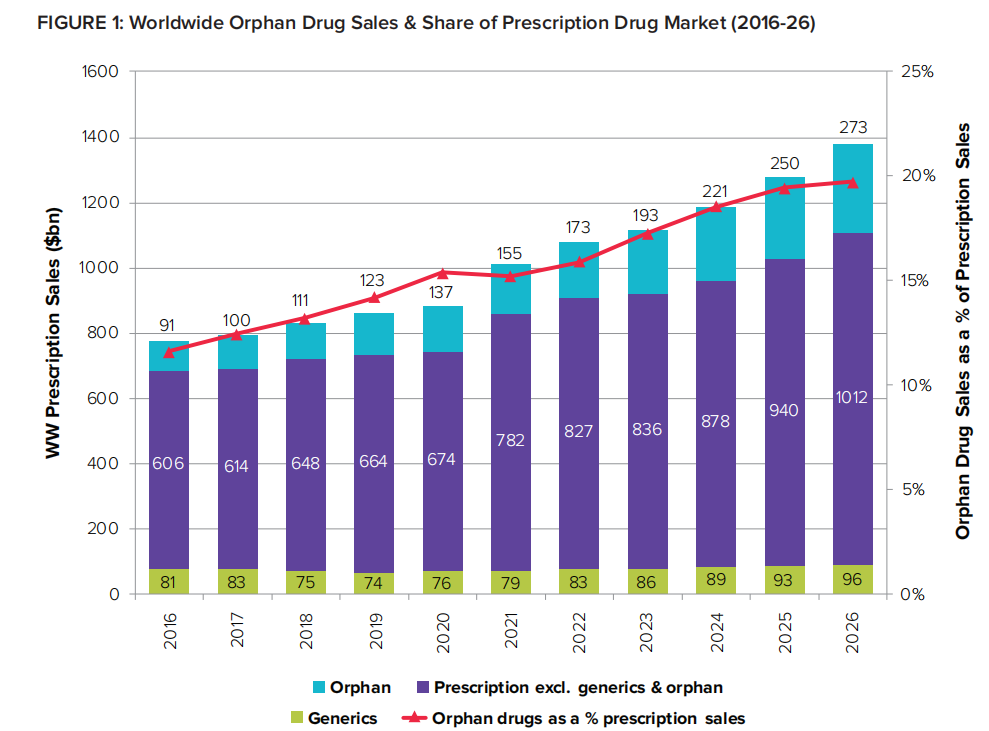
图1 2016-2026年全球孤儿药销售及处方药市场份额(图片来源Evaluate《2022 年孤儿药报告》)
支持罕见病新疗法的开发和评估是美国FDA的一个关键优先事项。美国FDA有权将某种药品或生物产品认定为孤儿药,认定其为预防、诊断或治疗罕见疾病或病症的药物或生物制品。获得孤儿药资格认定的药物可以享受一系列的激励政策,如临床试验费用的税收抵免、免除新药申请费、上市后享有7年的市场独占权等优惠政策。
欲申请药品或生物制品孤儿药资格认定的申办者必须向FDA提交认定申请,来评估其产品是否适合用于治疗、诊断或预防罕见疾病或病症。本文将就美国有关提交孤儿药认定申请的常见问题作一总结,供大家参考。为了便于阅读,本文行文方式以问答方式展开。
常见问题1 - 孤儿药资格认定申请的申报函上是否需要联系人的签名? 签名页可以单独发送吗?
答复:孤儿药认定申请的一份副本(通常是申报函)上需要有代表申办者的个人的原始签名。原始签名不一定是联系人。例如,申办者的CEO可能会在申报函上签字,但被列为联系人的个人是监管事务负责人。
常见问题2--孤儿药物认定申请可以以电子方式提交吗?需要什么?
答复:孤儿药认定申请可通过电子邮件提交至orphan@fda.hhs.gov.请附上注明日期并签名的申报函、参考书目和所有引用文献的完整副本(非摘要)。有关更多信息,请参阅指定孤儿药:药物和生物制品(Orphan Product: Drugs and Biological Products)。
常见问题3-关于孤儿药名称的哪些信息是公开的?如果申办者没有提供该药物的仿制药和商品名,该怎么办?
答复:如果一种产品被认定为孤儿药,有关孤儿药的某些信息(申办者的姓名、地址和联系信息、药物名称、孤儿药认定用途以及认定日期和状态)将在美国FDA的可搜索数据库中提供。
FDA将公布该药物的通用名和商品名,如果两者都不可用,则由申办者提供并经FDA批准药物的化学名称或有意义的描述性名称,并经FDA批准。更多信息请参见21CFR 316.28(b)节。
如果认定产品经FDA批准上市,网站上会提供某些额外信息(批准日期、批准的适应症和独占权状态)。
常见问题4 -一旦FDA收到孤儿药认定申请,审查过程是什么?
答复:FDA将向申办者(或申办者的代理)发送确认函。FDA对申请进行审查,这可能需要整个机构的协调。当FDA对申请的审查完成后,如果FDA确定该药物有资格获得孤儿药认定,FDA将向申办者发送认定函。申办人可能会收到要求提供额外信息的缺陷函或拒绝函(视情况而定)。
常见问题5-法规规定,申办者必须在孤儿药认定申请中提交有关其药物的所有相关数据。为什么申办者不必在孤儿药物认定申请中提交动物毒理学数据?
答复:为了将一种产品认定为孤儿药,认定申请的科学原理部分必须包括足够的信息,以建立期望该药物对罕见疾病有效的医学上合理的基础。该药物在治疗、预防或诊断这种罕见疾病方面的临床数据最能支持其科学原理。然而,在缺乏人类数据的情况下,在人类疾病的相关动物模型中使用该药物的临床前数据可能会令人满意地支持孤儿药物认定的申请。
在缺乏人类数据且不存在相关动物模型的情况下,FDA可能会考虑替代数据的组合,包括疾病的发病机制、药物及其对疾病的作用机制的明确描述以及支持性体外数据。
描述药物在动物中的安全性的动物毒理学数据不能提供疗效数据,并且通常与支持科学原理无关。只有在极少数情况下,在缺乏人体数据和相关体内模型的情况下,FDA才会考虑替代数据的组合,包括疾病的发病机制、药物及其对疾病的作用机制的明确描述以及支持的体外数据。
常见问题6 -孤儿药认定申请需要哪些信息?
答复:编写孤儿药认定申请的信息,请参阅创建孤儿药认定申请的推荐提示。
常见问题7-如果申办者来自外国,是否需要美国代理商提交认定申请?
答复:位于美国境外的申办者必须由美国永 久居民代理提交孤儿药认定申请。FDA与国际申办者之间的所有通信都应通过美国代理,包括在产品被认定为孤儿药后提交年度报告。
美国代理可以是居住在美国的任何人,他们负责认定申请所涉及的文书工作,如果认定被批准,将作为未来的主要联系人。如果申办者的美国代理发生变更,必须通知FDA。
常见问题8 -如果申办者难以找到患病率数据该怎么办?对于用于急性疾病的产品,是否应该使用少于20万人的发病率而不是流行率?
答复:除了参考文献和期刊外,许多罕见疾病的流行数据可以在政府和患者支持团体网站上找到。目前还没有被认为患病率低于20万的特定疾病的一般清单。应在认定申请中提供记录如何确定流行率估计的所有材料的副本。如果参考来源来自网站,则应包括文档的硬拷贝以及网站地址。还应为所有引用的网站来源提供每个网站的访问日期。
期望申办者在查找涉及美国人口的最新患病率数据方面做出真诚的努力。如果只有旧数据和/或国外的数据可用,申办者应在申请中对此作出解释。如果数据是旧的,申办者应该解释为什么数据仍是相关的,如果来自国外,为什么该国人口的数据也可以代表美国人口。
流行率估计必须是最新的,以反映提交孤儿药认定申请时的流行率(21CFR 316.21 (b))。为了更新这个估计,申办者应该使用美国人口普查局提供的美国人口数据。
提供所有计算结果并引用用于人口估计的参考文献。在提交孤儿药认定申请时,评估应该是最新的。美国人口普查局的数据可以用来更新任何人口估计。
当存在一系列估计时,FDA只接受最大的估计,除非提供理由说明为什么另一个估计更准确。
如果该药物用于诊断或预防罕见疾病或病症,请提供每年将使用该药物的估计人数。
如果一种疾病是急性疾病(例如持续时间少于一年),发病率可作为人口的估计值。然而,请注意,如果疾病是复发/缓解型疾病,且每次发作的持续时间都是急性的,可能仍然需要对患病率进行估计。
如果使用来自索赔数据库或国外数据的数据,请清楚地解释这些数据如何适用于美国人口以及数据的局限性。
美国国家癌症研究所的监测、流行病学和最终结果项目是确定美国癌症统计数据的推荐资源之一。
常见问题9 -如果药物的预期指定用途是预防而不是治疗,如何估计每种情况下的人群?
答复:如果药物用于预防,人口估计应该是美国每年将使用该药物的人数(21 CFR 316.21(b)(3))。
常见问题10 -在什么情况下,FDA会认定一种孤儿药,并承认其是具有独占权的新配方的药物,否则是相同的批准药物用于相同的罕见疾病或病症?
答复:《孤儿药法》的公共政策目标是刺激在开发罕见疾病和病症患者的治疗方法方面的创新,并促进临床优质药物的迅速供应。因此,FDA的规定有助于确保孤儿药的独占权不会妨碍治疗罕见疾病的重大改进。
FDA可以将孤儿药认定为与美国已经批准的用于治疗相同罕见疾病或病症的药物相同的药物,前提是申办者能够提出合理的假设,证明其药物在临床上可能优于先前批准的药物。参见21 CFR 316.20(a)了解更多信息。
临床优势可以通过在大部分目标人群中更有效、更安全,或在特殊情况下对患者护理做出重大贡献来建立。(21 CFR 316.3(b)(3).)
如果授予孤儿药认定资格,并且该药物获得了认定用途的上市批准,为了使该药物有资格获得孤儿药独占权,申办者必须证明该药物在临床上优于任何先前批准的相同用途的相同药物(21 CFR 316.34(c))。任何临床优势的主张都可能需要进行面对面的试验。
常见问题11 - FDA认为对患者护理的主要贡献是什么?
答复:在确定一种药物是否对病人护理作出重大贡献时,如果适用于严重或危及生命的疾病,在适当情况下可以考虑下列因素:治疗地点便利、治疗时间、患者舒适度、减少治疗负担、给药舒适性研究进展、剂量间隔时间较长、自我管理的潜力。
FDA在确定一种药物是否对患者护理有重大贡献时不能考虑的因素包括:治疗费用、对治疗的依从性(显著改善的依从性应通过更大的安全性或有效性来反映)
常见问题12 -请解释孤儿亚群。
答复:如果申办者能够根据药物的特性或特征解释为什么该药物将仅限于用于非罕见疾病的孤儿亚群,那么他们就可以获得孤儿药物的称号。孤儿亚群不是基于未满足的需求,或者申办者希望如何研究或指示药物。对孤儿亚群的解释必须清楚地表明,该药物永远不能用于该亚群以外的疾病或病症。参见21 CFR 316.3(b)(13)了解更多信息。
常见问题13 -如果在获得孤儿药资格认定后和提交NDA之前对产品配方进行了变更,已批准的NDA是否仍有资格获得独占权?
答复:孤儿药认定通常授予活性部分而不是产品配方,因此产品配方的变更通常不应影响孤儿药认定状态。
如果该申办者拥有该药物的孤儿药资格认定,那么第一个将活性部分推向市场用于特定用途或适应症的申办者通常有资格获得孤儿药独占权。如果申办者随后对原始产品的配方进行了变更,该产品已被认定并批准用于销售,我们认为申办者仍然拥有活性部分的资格认定。在变更制剂获得批准后,申办者将没有资格获得孤儿药独占权的新期限,除非申办者能够证明变更制剂在临床上优于最初批准的产品。
参考资料:
1-FDA官网
2- Evaluate《2022 年孤儿药报告》
作者简介:zhulikou431,高级工程师、PDA会员、ISPE会员、ECA会员、PQRI会员、资深无菌GMP专家,在无菌工艺开发和验证、药品研发和注册、CTD文件撰写和审核、法规审计、国际认证、国际注册、质量体系建设与维护领域,以及无菌检验、环境监控等领域皆具有较深造诣。近几年开始着力关注制药宏观领域趋势分析和制药企业并购项目的风险管理工作。




合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57