近日,恒瑞医药发布公告称,根据经营发展需要,提名聘任徐学健为副总经理,另据第一财经消息,徐学健还将担任恒瑞医药首席质量官,全面负责质量管理工作。
在加入恒瑞前,徐学健历任药明生物首席质量官和高级副总裁;药明康德质量部和美国药政部副总裁;美国FDA高级CMC评审员;美国PII制剂开发公司质量总监;创办上海福利康生物医药公司任总裁;美国惠氏(辉瑞)质量保证部高级主管;美国健赞公司高级科学家,值得一提的是,其在制药行业从业经历,多半除与质量相关,且与美国市场交集。
重塑生产质量国际化管理水平
不能绕行的出海“礁石”。2024年7月,恒瑞医药连云港一处制剂生产场地收到美国FDA警告信,在此前的6月,该地已收到美国FDA 483表格。美国FDA检查官员对医药产品生产企业质量保证体系进行现场检查,并以483表格的形式要求企业整改检查中出现的问题,若回复中未满足监管所有要求,即发出警告信,由此可见,美国FDA对恒瑞医药关于483表格的整改回复并不满意。
值得一提的是,恒瑞医药的“双艾”组合的登美计划,之前也因生产场地缺陷受阻,2024年5月,恒瑞收到美国FDA关于卡瑞利珠单抗联合甲磺酸阿帕替尼用于不可切除或转移性肝细胞癌患者一线治疗许可申请的完整回复信,FDA表示会基于企业对生产场地检查缺陷的完整答复进行全面评估。
徐学健的从业优势在于曾多次参与并顺利通过了美国FDA、EMA等21个官方机构的检查,总结了在中国建立一流质量体系的方法,有快速提升团队整体质量水平以达到国际一流质量标准的实践经验。
在频因生产场地质量问题遭美国FDA质疑的背景下,恒瑞医药聘任徐学健,其意图很明显,不光是解决目前存在的问题,更是要全面提升生产质量国际化管理水平,为后续站稳国际市场扫清“礁石”。
强中带弱,创新转型中的市场“失地”
恒瑞医药2023年营收228.20亿元,净利润43.02亿元,分别同比增长7.26%和10.14%,在历经2021和2022年连续两个年度的营收和净利润双下滑之后,终于消化了集采压力,迎来了业绩全面回暖。
特别是在创新转型的驱动下,恒瑞医药创新药板块价值已有大幅提升,2023年创新药不含对外许可的含税收入已达106.37亿元,相比2022年增长23.50%,占总营收比也由2022年的40.48%增长至46.61%,超百亿元的创新药销售收入,已让恒瑞医药在国内创新药领域位列第一梯队。
美中不足的海外营收。据恒瑞医药2023年报显示,主营业务医药制造业的营收为223.77亿元,其中,国内营收为217.60亿元,国外营收为6.17亿元,国外营收占比仅为2.76%。
从恒瑞医药之前的分地区营收结构来看,海外市场一直是恒瑞医药制造业务的市场“失地”,营收占比一直处于较低的个位数,2023年,海外营收占比也仅只是恢复到了2020年水平,相比2022年还有所下滑。
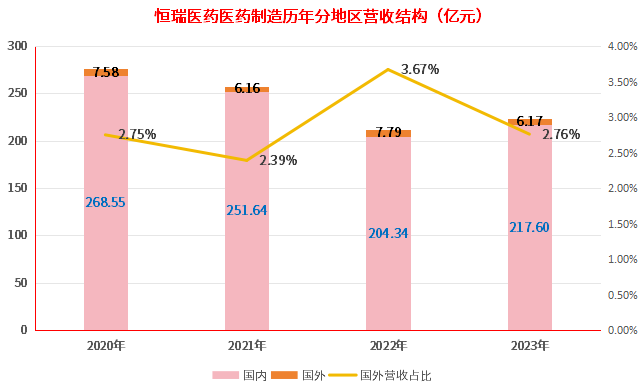
图片来源:根据恒瑞医药历年报整理
对比同样聚焦创新药的百济神州、和黄医药等国内药企,恒瑞医药的海外市场还有明显的提升空间,2023年,百济神州境外营收达96.22亿元,其中,为其境外营收贡献最大的是泽布替尼在美国和欧洲市场的销量增长,因此,百济神州也靠泽布替尼拿下首个“十亿美元分子”国产创新药。
和黄医药的产品销售收入增长也大幅来自海外市场。2023年,和黄医药产品销售收入为2.14亿美元,相比2022年增长0.47亿美元,其中,呋喹替尼(国内商品名为爱优特,美国商品名为FRUZAQLA)贡献最大,销售额增长0.29亿美元,其中,美国市场就占了增长额的51.89%。
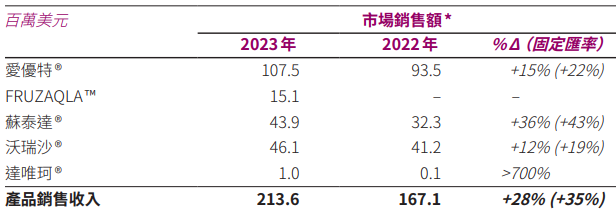
图片来源:和黄医药2023年报
值得一提的是,呋喹替尼在2023年11月才获美国FDA批准上市,2024年6月,呋喹替尼又获欧盟批准,笔者预计,和黄医药2024年的业绩最大增长点依然来自海外市场。
面对同行在海外市场的频频捷报,恒瑞医药又怎能坐得住。
先用仿制药征服美国市场。美国制药业的发达一直处于全球之首,要想在美国市场立足,也是不易之事,作为国内仿制药领域的佼佼者,恒瑞医药除了积极推进创新药“双艾”组合在美国落地外,也试图用重磅仿制药在美国打响名号。
2024年7月,恒瑞医药的布比卡因脂质体注射液获美国FDA批准上市,该药最早由美国Pacira研制,2011年在美国获批上市,商品名为Exparel,仅在美国和欧洲销售,2023年全球销售额约为5.38亿美元。
布比卡因是临床上广泛用于局部麻醉和术后镇痛的麻醉剂,相比普通注射剂的5-6小时作用时间,布比卡因脂质体注射液可将镇痛效果延长至数天,因其技术壁垒高,上市十余年无仿制品成功上市。2022年12月,恒瑞医药的布比卡因脂质体注射液在国内获批上市,其迅速将此“战果”延伸至美国,成为首家在美国获得该品种仿制药批准的药企。
值得一提的是,布比卡因脂质体注射液是恒瑞医药在美国拿下的第二款首仿药,2024年1月,恒瑞医药的他克莫司缓释胶囊获美国FDA批准上市,彼时,国内外尚无他克莫司缓释胶囊仿制药获批上市,2022年他克莫司全球销售额合计约为34.47亿美元。
连续2款全球首仿药在美国获批,已让恒瑞医药在创新药立足国际市场之前,在制药业最发达的美国先扬名立万。
转变研发思路,融入全球药物创新网络
据恒瑞医药2023年报显示,截至2024年3月底,其处于临床试验阶段的在研创新药多达91款,共开展了178项临床试验,而在4月以来,又至少有12款创新药(含改良新药)获批开展临床试验,加上已获批上市创新药的后续临床管线开发,恒瑞医药2023年研发投入高达61.50亿元。
借力进军海外市场。创新药领域的特点之一,就是License in/out交易频繁,不能像仿制药一样闷着头自己干,罗氏、辉瑞、阿斯利康、礼来、默沙东等MNC无不例外,为了尽快接轨国际竞争,融入全球药物创新网络,恒瑞医药一改往日在创新药领域单打独斗的思路。
2023年,恒瑞医药海外许可交易事项达5项之多,不仅是距上一次海外许可之后沉默近3年的“苏醒”,且是之前多年海外许可交易事项之和。
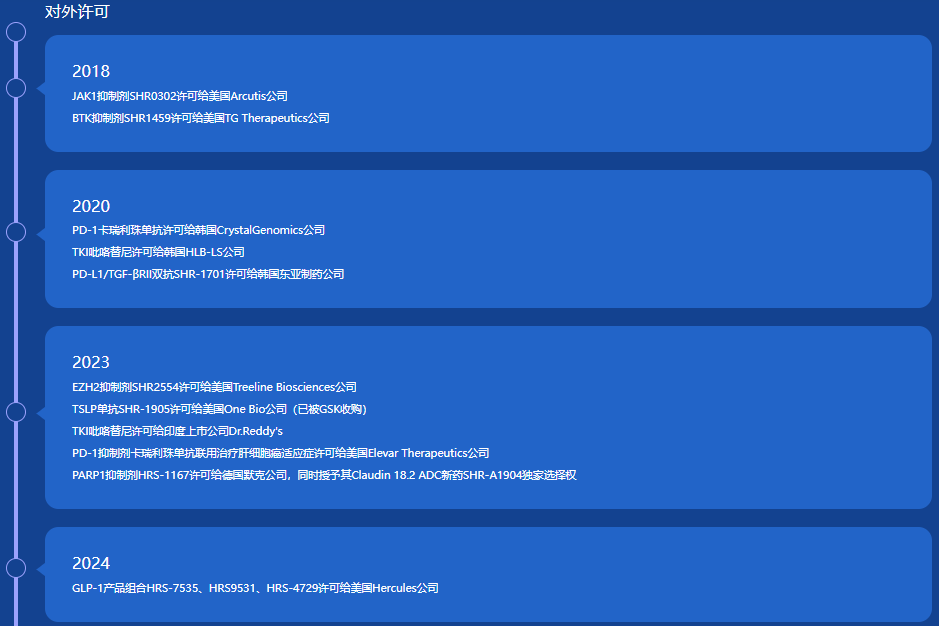
图片来源:恒瑞医药官网
值得一提的是,恒瑞在海外许可上也开始玩起“高端局”,2024年5月,恒瑞医药将自研且具有知识产权的GLP-1产品组合中国以外开发、生产和商业化独家权利,许可给美国Hercules,交易总金额高达约60亿美元,另将获得达到实际年净销售额低个位数至低两位数比例的销售提成,然而这都不是该笔交易的最大特点,最引人关注的是,恒瑞将获得Hercules的19.9%股份。
这一“玩法”,虽然在药圈中并不稀奇,但对恒瑞来说却是新鲜,该项交易可以理解为变相的分拆GLP-1管线资产,与合作方共同在美国成立了一家公司,根据合作协议,恒瑞医药与美国 Hercules设立联合管理委员会,双方各向联合管理委员会指派3名代表。
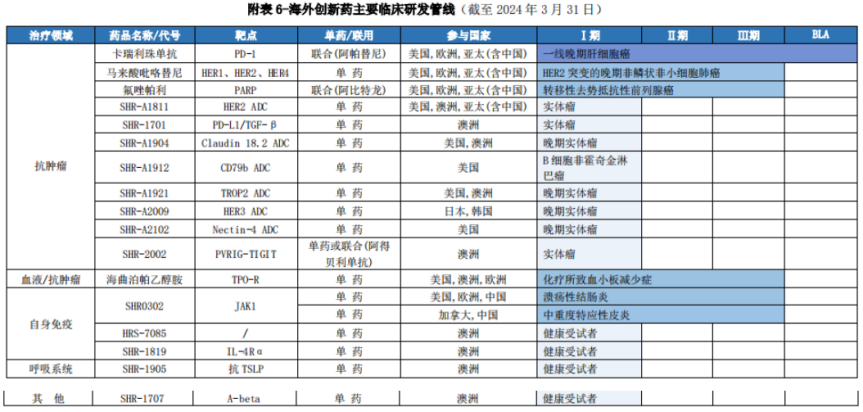
图片来源:恒瑞医药2023年报
特别是在MNC近年来积极备战的ADC领域方面,恒瑞医药的HER2(SHR-A1811)、Claudin 18.2(SHR-A1904)、TROP2(SHR-A1921)、HER3(SHR-A2009)、CD79b(SHR-A1912)和Nectin-4(SHR-A2102)等6个靶点的ADC药物实现了国内外同步研发,其中,SHR-A2009、SHR-A1921、SHR-A2102和SHR-A1912均已获美国FDA快速通道资格认定。
此外,在时下热门的双抗赛道上,恒瑞医药将自研的全球首创PVRIG-TIGIT双抗SHR-2002也实现了国内外同步开发。
海外许可思路的转变,以及海外创新药临床管线的建立,早晚将改变恒瑞创新药国内销售节节高,国外无人问津的格局。
小结
笔者认为,对恒瑞医药的认知应稍带包容之心,不能因美国FDA发出两三次关于生产场地的问题函,就草木皆兵,有错当然要改,但抛开恒瑞在仿制药领域的成绩,其在持续集采压力下,能从仿制药成功转型,且截至2023年底在国内获批上市15款1类创新药和4款2类新药,就已属不易。
还是像当初由仿向创转型一样,恒瑞正在不断蓄积力量来一场由内向外的进攻,这场进攻注定精彩。
恒瑞医药官网、公告及年报



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57